Grundkurs Tierphysiologie - Institut für Biologie und Neurobiologie ...
Grundkurs Tierphysiologie - Institut für Biologie und Neurobiologie ...
Grundkurs Tierphysiologie - Institut für Biologie und Neurobiologie ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Gr<strong>und</strong>kurs</strong> <strong>Tierphysiologie</strong><br />
Kursanleitung <strong>für</strong> den Teil <strong>Neurobiologie</strong><br />
Fachbereich <strong>Biologie</strong>, Chemie, Pharmazie<br />
der Freien Universität Berlin<br />
<strong>Institut</strong> <strong>für</strong> <strong>Biologie</strong><br />
WS 2006/2007
Inhaltliche Übersicht:<br />
Vorbemerkungen ............................................................................................................ 1<br />
Erfolgskontrolle .............................................................................................................. 5<br />
Literatur .......................................................................................................................... 6<br />
Statistische Gr<strong>und</strong>begriffe .............................................................................................. 7<br />
Ringer-Lösungen ............................................................................................................ 10<br />
Gr<strong>und</strong>lagen der elektrophysiologischen Messtechnik <strong>und</strong> der<br />
Erregungsbildung im Nervensystem ............................................................................... 13<br />
1. Versuchstag:<br />
Extrazelluläre Ableitung von Aktionspotentialen eines identifizierten Neurons vom<br />
Bauchmark der Wanderheuschrecke ............................................................................. 33<br />
2. Versuchstag:<br />
Computersimulation von Nervensignalen ....................................................................... 37<br />
3. Versuchstag:<br />
Auslösung <strong>und</strong> Erregungsleitung von Aktionspotentialen im Bauchmark<br />
des Regenwurms, Lumbricus terrestris .......................................................................... 44<br />
4. Versuchstag:<br />
Funktionsweise eines Mechanorezeptors:<br />
Der Flügelstreckrezeptor der Wanderheuschrecke ......................................................... 53<br />
5. Versuchstag:<br />
Farbensehen (Psychophysische Experimente zum Farbensehen) ................................. 61<br />
6. Versuchstag:<br />
Simulation neuronaler Netzwerke (<strong>für</strong> Bioinformatiker) ................................................... 76
Vorbemerkung<br />
Das Tierphysiologische Gr<strong>und</strong>praktikum mit seinen Teilen Verhaltensbiologie, <strong>Neurobiologie</strong><br />
<strong>und</strong> Stoffwechselphysiologie ist eine integrierte Lehrveranstaltung, die Sie mit verschiedenen<br />
Lern- <strong>und</strong> Lehrformen (Vorlesung, Seminar, Praktikum) mit dem Thema vertraut macht.<br />
Die VORLESUNG "Einführung in die <strong>Neurobiologie</strong>" (Di, Do, Fr, 13.15 – 14.00 Uhr, Großer<br />
Hörsaal der Pflanzenphysiologie, Königin-Luise-Str. 12-16) ist Bestandteil des "<strong>Gr<strong>und</strong>kurs</strong>es<br />
<strong>Tierphysiologie</strong>, Teil <strong>Neurobiologie</strong>", <strong>und</strong> ihr Besuch ist <strong>für</strong> alle Teilnehmer an diesem <strong>Gr<strong>und</strong>kurs</strong><br />
verpflichtend!<br />
Beginn der Vorlesung Teil Verhalten: 19.10.06<br />
Beginn der Vorlesung Teil <strong>Neurobiologie</strong>: 14.11.06<br />
Beginn der Vorlesung Teil Biochemie u. Stoffwechselphysiologie: 09.01.07<br />
Nach einer Einführung in die Morphologie <strong>und</strong> Anatomie von Nervensystemen, Neuronen<br />
<strong>und</strong> Gliazellen werden die wichtigsten physiologischen Gr<strong>und</strong>lagen besprochen. Danach<br />
werden die Phänomene von Membranruhepotentialen <strong>und</strong> Aktionspotentialen sowie die<br />
aktiven <strong>und</strong> passiven Mechanismen elektrischer Fortleitung behandelt. Wichtig <strong>für</strong> die<br />
Funktion des Nervensystems sind die Kontaktstellen zwischen den Neuronen, die Synapsen,<br />
deren Bau sowie Modulierbarkeit ausführlich besprochen werden. Welche intrazellulären<br />
Signalkaskaden durch Transmitter in Zielzellen ausgelöst werden, ist ebenfalls Gegenstand<br />
dieser Vorlesung. Ausführlich werden dann motorische Systeme wie Muskeln <strong>und</strong> ihre<br />
Ansteuerung sowie sensorische Systeme besprochen. Hier werden Schwerpunkte auf<br />
visuelle, mechanorezeptive <strong>und</strong> chemosensorische Systeme gelegt. Abschließend werden<br />
dann die integrativen Funktionen <strong>und</strong> höheren Leistungen des Nervensystems wie Lernen<br />
<strong>und</strong> Gedächtnis besprochen.<br />
Literatur:<br />
Clauss, W., Clauss, C. <strong>Tierphysiologie</strong> kompakt. Elsevier-Spektrum 2007<br />
Dudel, Menzel, Schmidt, Neurowissenschaft, Springer<br />
Kandel, Schwarz, Jessell, Neurowissenschaften, Spektrum<br />
Nicholls, Martin, Wallace, Vom Neuron zum Gehirn, Fischer<br />
Den Nebenfachstudenten <strong>und</strong> den Bioinformatikern empfehlen wir:<br />
Reichert, H., <strong>Neurobiologie</strong>, Thieme Verlag, Stuttgart 2000<br />
Zusätzliche Informationen zu den Vorlesungen inklusive Folienmaterial erhalten Sie über das<br />
Internet. Rufen Sie dazu die Homepage der <strong>Neurobiologie</strong> auf (www.neurobiologie.fuberlin.de)<br />
<strong>und</strong> klicken dann am linken Bildschirmrand unter Wintersemester auf die Infos der<br />
entsprechenden Vorlesung.<br />
1
Die SEMINARE zu jedem Praktikumstag dienen dazu, die <strong>für</strong> die praktische Arbeit dringend<br />
notwendige Mindestkenntnis aus dem in der Vorlesung theoretisch Erarbeiteten noch einmal<br />
zusammenzustellen <strong>und</strong> Ihre Fragen zum Vorlesungsstoff zu beantworten. Außerdem gibt<br />
Ihnen das Seminar darüber hinaus die Möglichkeit, alle Fragen zu behandeln, die sich im<br />
Verlauf der eigenen Beschäftigung mit dem Stoff ergeben haben. Davon sollten Sie regen<br />
Gebrauch machen.<br />
Der Besuch des Seminars ist ebenfalls Pflicht! Die Anwesenheit wird überprüft.<br />
Im PRAKTIKUM werden Sie mit der Experimentierweise der Neuro- <strong>und</strong> Verhaltensbiologie<br />
bekannt gemacht, können selbst elektrische Potentiale von Nervenzellen <strong>und</strong> Sinneszellen<br />
ableiten, Simulationen am Computer durchführen <strong>und</strong> Verhaltensweisen von Tieren<br />
beobachten <strong>und</strong> quantifizieren. Bitte wenden Sie sich bei auftauchenden Problemen an<br />
einen der Betreuer (auch außerhalb des Versuchstages; Zeit vereinbaren!).<br />
Eine Bitte: Verlassen Sie nach Abschluß eines Versuchs den Arbeitsplatz nicht, ohne<br />
ihn gesäubert <strong>und</strong> aufgeräumt zu haben!! Es finden 10 parallele Kurse statt, nicht nur<br />
ihrer.<br />
Einige Gedanken zur Tierversuchsproblematik<br />
Obwohl es heute möglich ist, Experimente zu Lehrzwecken am Computer zu simulieren, was<br />
wir übrigens auch in unserem Praktikum durchführen, hat diese Art der "Praktikumsexperimente"<br />
ihre eigene Problematik. Es entfällt damit nämlich die eigene Erfahrung mit dem<br />
Arbeiten am biologischen Objekt. Es ist daher notwendig, daß die Untersuchung des<br />
Nervensystems eines Tieres auch Experimente am lebenden Organismus beinhaltet. Ein<br />
Ausweichen auf Präparate von Teilen des Nervensystems, die natürlich dem vorher getöteten<br />
Tier entnommen werden müssen, ist in Einzelfällen möglich. Für neurobiologische<br />
Fragestellungen, die das Gesamtsystem betreffen, muß auch am ganzen Tier experimentiert<br />
werden. Oberste Leitlinie <strong>für</strong> den Tierversuch muß sein, den Versuch vor Beginn des Experiments<br />
so gut wie möglich zu planen, um dem Tier möglichst wenig Schmerzen zu bereiten<br />
<strong>und</strong> die Zahl der Tierversuche so gering wie möglich zu halten. Solange die wissenschaftliche<br />
Lehre ein forschendes Lernen ist, halten es die Lehrveranstalter <strong>für</strong> erforderlich, daß<br />
Sie einmal während des Studiums Tierversuche kennenlernen <strong>und</strong> durchführen. Während<br />
des Praktikums machen Sie zwei Tierversuche (am 1. Tag Ableitung eines Interneurons bei<br />
der Heuschrecke <strong>und</strong> am 3. Tag Versuche am Regenwurm), während bei dem übrigen<br />
Versuch (Streckrezeptor bei der Heuschrecke) das Tier vorher getötet wurde. Für diese Tierversuche<br />
werden wirbellose Tiere verwendet, bei denen Schmerzrezeptoren nicht nachgewiesen<br />
<strong>und</strong> trotz intensiver Suche nicht gef<strong>und</strong>en wurden. Vielerlei Gründe, die wir Ihnen<br />
2
dann während des Praktikums gerne ausführlich auseinandersetzen, lassen den Schluß zu,<br />
daß wirbellose Tiere keinen Schmerzsinn bzw. keine Schmerzempfindungen, so wie wir es<br />
verstehen, besitzen. Diesem Umstand ist es u.a. zuzuschreiben, daß Tierversuche an<br />
wirbellosen Tieren nicht genehmigungspflichtig sind. Das Tierschutzgesetz in seiner Neufassung<br />
vom 18. August 1986 verpflichtet Sie <strong>und</strong> uns dennoch, über jeden Tierversuch ein<br />
Protokoll anzufertigen. Im übrigen empfehlen wir Ihnen dringend, sich mit den Bestimmungen<br />
des Tierschutzgesetzes (Fassung vom 18. August 1986) <strong>und</strong> den allgemeinen<br />
Verwaltungsvorschriften zur Durchführung des Tierschutzgesetzes (vom 28. Juli 1987)<br />
vertraut zu machen.<br />
Noch ein Gedanke zum Schluß dieser Vorbemerkung: Zur Präparation können auch wirbellose<br />
Tiere "betäubt" werden. Dies geschieht in unserem Praktikum durch Herabkühlen der<br />
Körpertemperatur (Kühlschrank oder auf Eis; ca. 15 min.). Gelegentlich werden Insekten<br />
auch durch CO 2 -Gabe betäubt.<br />
Der Einsatz von lebenden Tieren <strong>für</strong> Ihre praktische Arbeit verpflichtet Sie <strong>und</strong> uns, den<br />
größtmöglichen Erkenntnisgewinn aus jedem Experiment zu ziehen <strong>und</strong> die größtmögliche<br />
Sorgfalt beim Umgang mit unseren Versuchstieren walten zu lassen. Helfen Sie uns dabei<br />
mit Ihrer konzentrierten Mitarbeit.<br />
Geräte: Bitte Vorsicht bei der Handhabung der z.T. kostspieligen Apparate <strong>und</strong> der<br />
Computer. Lassen Sie sich die Apparate zunächst von den Betreuern erklären. Im Bereich<br />
der <strong>Neurobiologie</strong> dient der erste Kurstag speziell der Einführung in die Benutzung der<br />
wichtigsten Geräte <strong>und</strong> dem Kennenlernen des gr<strong>und</strong>legenden Versuchsaufbaus.<br />
Präparierbesteck: Folgende Utensilien sind mitzubringen: Präparierbesteck (grobe Schere,<br />
feine Schere, grobe <strong>und</strong> feine Pinzette, Stecknadeln), Millimeterpapier, Lineal, Taschenrechner,<br />
Protokollheft DINA4, Bleistifte, Buntstifte, Radiergummi, Spitzer, Filzschreiber.<br />
Protokolle: Über jeden der Praktikumstage fertigen Sie ein Gruppenprotokoll an, das so<br />
knapp wie möglich <strong>und</strong> leserlich abgefaßt werden soll. Da Sie in 3er-Gruppen arbeiten,<br />
raten wir Ihnen dringend, dieses Gruppenprotokoll in wirklicher Gemeinschaftsarbeit anzufertigen<br />
<strong>und</strong> dieses vor Abgabe miteinander zu besprechen. Ungünstig auf die Protokolle<br />
wirkt sich aus, wenn nur eine Person der Dreiergruppe das Protokoll anfertigt, oder die<br />
Erstellung auf die Einzelpersonen aufgeteilt wird <strong>und</strong> das Protokoll dann ohne gemeinsame<br />
Diskussion zusammengesetzt wird. Da das Protokoll eine wesentliche Gr<strong>und</strong>lage unserer<br />
3
Beurteilung Ihrer erfolgreichen Teilnahme am gesamten <strong>Gr<strong>und</strong>kurs</strong> ist, geben wir Ihnen<br />
folgende Anregungen zur Anfertigung eines Protokolls:<br />
Es ist sinnvoll, sich bei der Gliederung des Protokolls an das Schema wissenschaftlicher<br />
Veröffentlichungen zu halten. Es besteht aus:<br />
• Titelseite (Thema des Kurstages, Namen der Gruppenteilnehmer,<br />
Kurstag, Betreuer, Tutor)<br />
• Einleitung zum Thema des Versuchs<br />
• Material <strong>und</strong> Methoden<br />
• Ergebnisse (ausführliche verbale <strong>und</strong> zeichnerische Darstellung)<br />
• Diskussion<br />
In einer Einleitung stellen Sie den theoretischen Hintergr<strong>und</strong> des Experiments dar. Das<br />
Seminar zu dem Praktikumstag, die Zusammenarbeit mit den Tutoren <strong>und</strong> unser Skript<br />
werden Sie darüber informieren, welcher Stoff jeweils dazu gehört. Am Ende der Einleitung<br />
formulieren Sie die Fragen, die Sie mit dem (den) Experiment(en) beantworten wollen.<br />
Denken Sie daran, daß die Experimente kein Selbstzweck sind, sondern dazu dienen, Ihre<br />
praktischen Fähigkeiten zu vergrößern <strong>und</strong> Ihren Erkenntnisgewinn durch praktische Arbeit<br />
zu fördern <strong>und</strong> zu vertiefen. Sie müssen also schon genau wissen, was Sie mit dem Experiment<br />
aufklären wollen. Im Abschnitt Material <strong>und</strong> Methoden beschreiben Sie den Versuchsaufbau<br />
<strong>und</strong> die Hilfsmittel des Experiments (Schaltplan, Geräte, Art der Datengewinnung,<br />
statistische Methoden). Im Ergebnisteil geben Sie ausführlich alle Ergebnisse<br />
wieder, beschreiben den Versuchsverlauf, leiten von einem Teilexperiment zum nächsten<br />
über, beschreiben die Ergebnisse <strong>und</strong> wählen die jeweils günstigste Form der Darstellung<br />
(Zeichnung, Tabellen, Graphik, Säulendiagramm). Ein besonders wichtiger Abschnitt des<br />
Protokolls ist die Diskussion. Hier zeigen Sie, was Sie das Experiment gelehrt hat,<br />
besprechen Fehlerquellen, vergleichen die Ergebnisse mit dem Lehrbuchwissen <strong>und</strong><br />
kritisieren Ihr Vorgehen bzw. den Ansatz des Experiments. Das Protokoll ist damit eine<br />
wichtige Vorübung <strong>für</strong> die Dokumentation <strong>und</strong> Präsentation Ihrer eigenen, zukünftigen<br />
wissenschaftlichen Arbeiten. Die Lehrveranstalter werden Ihr Protokoll sehr genau lesen <strong>und</strong><br />
mit Ihnen besprechen. Mitunter ergibt sich die Notwendigkeit, daß Sie Ihr Protokoll nochmals<br />
überarbeiten oder neu schreiben. Wir raten Ihnen noch einmal dringend, daß jede/r von<br />
Ihnen den Versuchstag während der Experimente protokolliert, <strong>und</strong> Sie daraus in einer<br />
Gruppenarbeit ein gemeinsames Protokoll erstellen, zu dem alle 3 Gruppenmitglieder beigetragen<br />
haben. Dieses Protokoll sollten Sie unmittelbar nach Durchführung des Versuchs<br />
4
(innerhalb von 3 Tagen) erstellen <strong>und</strong> zur Durchsicht dem jeweiligen Lehrveranstalter übergeben.<br />
Um der zunehmenden Unsitte, Protokolle aus sogenannten "Altmeistern" oder aus<br />
Protokollsammlungen abzuschreiben, oder ganze Textpassagen ohne Quellenangabe<br />
aus dem Internet zu kopieren, Einhalt zu gebieten, sind Sie verpflichtet, zusammen<br />
mit einem Ausdruck Ihres Protokolls dieses auch als Worddokument an den/die<br />
jeweilige/n Lehrveranstalter/in zu schicken oder auf einer CD abgespeichert<br />
abzugeben. Wir werden Ihre Protokolle mit geeigneten Suchprogrammen stichpunktartig<br />
überprüfen. Solle Ihnen ein Betrug nachgewiesen werden, führt dies dazu, daß<br />
Ihre Teilnahme am Praktikum sofort beendet wird <strong>und</strong> Sie Gefahr laufen, von der<br />
Universität verwiesen zu werden.<br />
Erfolgskontrolle:<br />
1. Benoteter Schein<br />
2.1 Jedes der Gruppenprotokolle wird benotet, wobei Gelegenheit besteht, nach ausführlicher<br />
Protokollbesprechung mit dem/r Lehrveranstalter/in dieses noch einmal vorzulegen.<br />
Die Gesamtprotokollnote ergibt sich aus dem Mittel der Einzelnoten der 5<br />
Versuchsprotokolle. Jedes einzelne Protokoll muß mit mindestens "ausreichend"<br />
bewertet werden. Die mittlere Note der Protokolle geht in die Endnote mit 30% ein.<br />
2.2 Zusätzlich gibt es am Ende des Teils <strong>Neurobiologie</strong> eine schriftliche Klausur von 1<br />
Std. Dauer. Gegenstand der Klausur sind die Inhalte der Vorlesung, der Seminare<br />
<strong>und</strong> des Praktikums. Diese Prüfung muß mit mindestens "ausreichend" bewertet<br />
werden. Es besteht die Möglichkeit zur Wiederholung der Klausur gemaß den<br />
Bestimmungen des Fachbereichs.<br />
Die Gesamtnote setzt sich dann aus dem Mittel der Gesamtprotokollnote <strong>und</strong> der<br />
Note aus der schriftlichen Klausur zusammen. Bei freiwilliger Wiederholung einer<br />
Klausur gilt: bei zwei Noten Unterschied wird die mittlere Note festgelegt, bei einer<br />
Note Unterschied gilt die bessere Note; <strong>und</strong> wenn die Wiederholungsnote "nicht<br />
bestanden" heißt, gilt diese nicht. Bei Teilnahme an der Nachklausur wegen "nicht<br />
bestanden" gilt die Note der Nachklausur. Im Falle einer Wiederholungsklausur gilt<br />
die vorangegangene Klausur als nicht durchgeführt.<br />
5
Die Gesamtnote des tierphysiologischen Kurses ergibt sich dann aus den jeweiligen<br />
gewichteten Teilnoten (Anteilsgewichtung). Insgesamt ergeben Vorlesung, Seminar<br />
<strong>und</strong> Praktikum des tierphysiologischen Gr<strong>und</strong>praktikums, bestehend aus allen Teilen<br />
(Verhaltensbiologie, <strong>Neurobiologie</strong> <strong>und</strong> Stoffwechselphysiologie) 14 ECTS-Punkte:<br />
Vorlesung:<br />
Praktikum inkl. Seminar:<br />
3 SWS = 6 ECTS<br />
6 SWS = 8 ECTS<br />
Noten:<br />
grade A excellent hervorragend 1,0 - 1,5<br />
grade B very good sehr gut > 1,6 - 2,0<br />
grade C good gut > 2,1 - 3,0<br />
grade D satisfactory befriedigend > 3,1 - 3,5<br />
grade E sufficient ausreichend > 3,6 - 4,0<br />
grade F fail nicht bestanden > 4,1 - 5,0<br />
Der Termin <strong>für</strong> die schriftliche Klausur wird während des Praktikums bekannt<br />
gegeben.<br />
Studenten der Bioinformatik nehmen nur am Teil <strong>Neurobiologie</strong> teil, der um einen 6.<br />
Kurstag <strong>und</strong> weitere Vorlesungsteile erweitert ist. Bioinfromatikstudenten erhalten 2<br />
ECTS <strong>für</strong> die Vorlesung <strong>und</strong> 6 ECTS <strong>für</strong> das Seminar <strong>und</strong> Praktikum. Sie haben<br />
neben der o.g. 1-stündigen Klausur eine weitere ½-stündige Klausur über weitere<br />
Inhalte der Vorlesung abzulegen.<br />
Literatur:<br />
Wir geben Ihnen einige Lehrbücher an, die wir zur eigenen Vor- <strong>und</strong> Nachbereitung<br />
empfehlen. Sie sollten in jedem Fall auch ein allgemeines Lehrbuch der Zoologie (z.B.<br />
Wehner, Gehring, "Allgemeine Zoologie"; Thieme-Verlag) oder Gr<strong>und</strong>studium <strong>Biologie</strong><br />
(Zoologie, K. Munk, Spektrum Verlag) oder der <strong>Biologie</strong> haben. Darin werden Sie auch<br />
Abschnitte über die Sinnes-, Nerven-, Muskelphysiologie <strong>und</strong> über die Verhaltensbiologie<br />
finden. Beachten Sie auch die Lehrbücher zu diesem <strong>Gr<strong>und</strong>kurs</strong> in der Bereichsbibliothek<br />
<strong>Biologie</strong> im Botanischen Museum (Königin-Luise-Str. 6-8). Die Theorie zum Kurs orientiert<br />
sich an Dudel, Menzel, Schmidt (2001) Neurowissenschaft - Vom Molekül zur Kognition, 2.<br />
Auflage, Springer Verlag Berlin; Eckert, Randall (2002) <strong>Tierphysiologie</strong> (4. Auflage, Thieme)<br />
<strong>und</strong> Nicholls, Martin, Wallace (2002) Vom Neuron zum Gehirn. Spektrum Verlag,<br />
6
Heidelberg; Kandel, Schwartz, Jessell (1996) Neurowissenschaften - Eine Einführung,<br />
Spektrum Verlag.<br />
Den Bioinformatikern emfpehlen wir auch: Reichert, <strong>Neurobiologie</strong>, Thieme-Verlag, Stuttgart<br />
2000.<br />
Wir empfehlen auch die Lehrbücher:<br />
Penzlin, H. (2005): Lehrbuch der <strong>Tierphysiologie</strong>, 7. Auflage, Spektrum-Verlag, Heidelberg.<br />
Schmidt, R.F., Thews, G. (2004): Physiologie des Menschen. 29. Auflage, Springer-Verlag.<br />
Berlin, Heidelberg, New York.<br />
Erkenntnistheoretische <strong>und</strong> historische Fragen werden in folgenden interessanten Büchern<br />
angesprochen:<br />
Florey, E. & Breidbach, O. (1993): Das Gehirn - Organ der Seele? Zur Ideengeschichte der<br />
<strong>Neurobiologie</strong>. Akademie Verlag, Berlin.<br />
Roth, G. (2001): Das Gehirn <strong>und</strong> seine Wirklichkeit. Suhrkamp, Frankfurt/Main.<br />
Noch ein Wort zur Wissenschaftssprache:<br />
Englisch ist mittlerweile das "Latein der Wissenschaftler", <strong>und</strong> ohne Kenntnisse der<br />
englischen Sprache ist wissenschaftliches Arbeiten kaum mehr denkbar. Wir empfehlen<br />
Ihnen deshalb, sich auch ein englisches Lehrbuch zuzulegen (z.B. sind einige der angegebenen<br />
deutschen Lehrbücher Übersetzungen von englischen Ausgaben). Die Lehrveranstalter<br />
werden Ihnen dazu gerne Empfehlungen geben.<br />
Statistische Gr<strong>und</strong>begriffe<br />
Wenn möglich sind alle Messungen mehrfach auszuführen, um einen Begriff von Ihrer<br />
Schwankungsbreite zu bekommen. Meßwerte, die weit aus der Reihe der übrigen herausfallen,<br />
dürfen nicht einfach weggelassen werden. Versuchen Sie durch Diskussion mit einem<br />
Betreuer, die Ursache des Fehlers zu ergründen. Bei Mittelwertbildung ist die Fehlerbreite<br />
durch Angabe des Streuungsmaßes (Standardabweichung) anzugeben. Alle Meßdaten<br />
werden sofort in ein Protokollheft eingetragen (keine einzelnen Schmierzettel benutzen!).<br />
Graphische Darstellungen auf Millimeterpapier auftragen <strong>und</strong> ins Heft einkleben. Alle<br />
Originalaufzeichnungen <strong>und</strong> Zwischenrechnungen mit dem Protokoll abgeben.<br />
Aufgr<strong>und</strong> der Variabilität biologischer Objekte, Schwankungen der Meßbedingungen <strong>und</strong><br />
unvermeidlicher Meßfehler streuen die Meßwerte eines untersuchten Parameters stets in<br />
gewissem Maße. Es ergibt sich eine Häufigkeitsverteilung von Daten einer Stichprobe, die in<br />
7
vielen Fällen einer Normalverteilung (Gauß'sche Kurve) entspricht. Sie kann durch<br />
Berechnung des Mittelwertes X <strong>und</strong> der Standardabweichung s charakterisiert werden.<br />
Beträgt die Anzahl der Meßwerte einer Stichprobe n <strong>und</strong> bezeichnet man die einzelnen<br />
Meßwerte mit x i (<strong>für</strong> i = 1 bis n) so gilt <strong>für</strong> den Mittelwert:<br />
<strong>und</strong> <strong>für</strong> die Standardabweichung:<br />
(1)<br />
(2)<br />
Bei der Normalverteilung liegen zwischen X ± 3s 99,9% aller Meßwerte, d.h. die Wahrscheinlichkeit<br />
da<strong>für</strong>, daß ein Meßwert, der zu dieser Verteilung gehört, in dem Bereich X ±<br />
3s liegt, ist nahezu p = 1.<br />
Das Verhältnis der Standardabweichung zum Mittelwert wird Variationskoeffizient oder<br />
Variationszahl genannt <strong>und</strong> mit V bezeichnet.<br />
(3)<br />
Der Variationskoeffizient ist ein relatives, dimensionsloses Streuungsmaß mit dem Mittelwert<br />
als Einheit. Da sein Maximum n-1 beträgt, gibt man auch gern den in Prozent ausgedrückten<br />
relativen Variationskoeffizienten V r an:<br />
(4)<br />
Eine häufig ange- wandte Methode, um etwas über die<br />
8
Abhängigkeit zwischen zwei Merkmalen zu erfahren, ist die Korrelations- <strong>und</strong><br />
Regressionsanalyse. Im einfachsten Fall kann zwischen Merkmalen ein linearer funktionaler<br />
Zusammenhang bestehen. Aufgr<strong>und</strong> von Meßfehlern <strong>und</strong> der natürlichen Variabilität<br />
biologischer Merkmale (Meßgrößen) kann statt eines funktionalen meist nur ein<br />
stochastischer Zusammenhang zwischen Merkmalen festgestellt werden, d.h. einem<br />
bestimmten Wert eines Merkmals entspricht nicht immer genau ein Wert des anderen<br />
Merkmals. Die aus solchen Messungen in einem Koordinatensystem entstehende Punktwolke<br />
läßt sich aber häufig durch einen stochastischen linearen Zusammenhang mittels<br />
einer Regressionsgeraden beschreiben. Dabei gibt die Korrelation zwischen den beiden<br />
Merkmalen an, ob ein linearer stochastischer Zusammenhang besteht, während die<br />
Regression beschreibt, welcher Zusammenhang besteht.<br />
Die Korrelation kann durch den Korrelationskoeffizienten r geschätzt werden:<br />
Σxy-1/n(Σx)(Σy)<br />
r = (5)<br />
[Σx 2 -1/n(Σx) 2 ][Σy 2 -1/n(Σy) 2 ]<br />
Für 0 < r < 1 besteht ein positiv-linearer Zusammenhang <strong>und</strong> <strong>für</strong> -1 < r < 0 ein negativlinearer<br />
Zusammenhang. Für r = 0 sind die beiden Merkmale linear-unabhängig. Funktionale<br />
Zusammenhänge führen zu Werten von r = 1 oder r = -1.<br />
Durch die Regressionsanalyse kann an eine beobachtete Punktewolke eine Regressionsgleichung<br />
angepaßt werden. Bei vorausgesetztem linearen Zusammenhang entspricht diese<br />
der Geradengleichung<br />
y = a + bx (6)<br />
mit folgenden Beziehungen <strong>für</strong> die Schätzung der Steigung oder des Regressionskoeffizienten<br />
b = [Σxy-1/n(Σx)(Σy)]/[Σx 2 -1/n(Σx) 2 ] (7)<br />
<strong>und</strong> des Achsenabschnittes<br />
a = (Σy-bΣx)/n (8)<br />
9
Ringer-Lösungen<br />
(Nach Clark: "A practical course in experimental zoology"; Seite 206)<br />
Herstellung:<br />
(1) Man stellt die angegebenen Stammlösungen entsprechender Molarität her (1 molare<br />
Lösung = 1 Mol, Molekulargewicht in Lösung gebracht <strong>und</strong> in Aqua dest. auf 1 Liter<br />
aufgefüllt).<br />
(2) Mischung: Die Stammlösungen werden in den angegebenen Mengen <strong>und</strong> in der<br />
Reihenfolge von oben nach unten <strong>für</strong> die jeweiligen Tierarten gemischt <strong>und</strong> mit Aqua<br />
dest. auf 1 Liter aufgefüllt.<br />
Stammlösungen Frosch Insekt Regenwurm<br />
NaCl<br />
0,54 M (= 31,56 g/l) 210 ml 290 ml 250 ml<br />
KCL<br />
0,54 M (= 40,26 g/l) 6,5 ml 5,0 ml 5,0 ml<br />
MgCl 2<br />
0,36 M (= 34,28 g/l) -- -- 1,0 ml<br />
NaHCO 3<br />
0,54 M (= 45,37 g/l) 4,5 ml -- --<br />
CaCl 2<br />
0,36 M (= 39,95 g/l) 5,0 ml 5,0 ml 5,0 ml<br />
Wichtiger Tip: Erst die angegebenen Mengen von NaCl, KCL, MgCl 2 <strong>und</strong> NaHCO 3<br />
zugeben, dann mit Aqua dest. fast bis auf 1 l verdünnen (z.B. bis ca.<br />
900 ml), dann das CaCl 2 zugeben <strong>und</strong> schließlich bis genau auf die<br />
1l-Eichmarke auffüllen.<br />
10
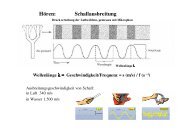
Gr<strong>und</strong>lagen der elektrophysiologischen Meßtechnik<br />
Bevor Sie mit dem ersten Versuch beginnen, sollten Ihnen drei in der Elektrophysiologie<br />
sehr häufig verwendete Geräte vorgestellt werden, nämlich Oszilloskop, Differenzverstärker<br />
<strong>und</strong> Reizgerät. In der Kürze der zur Verfügung stehenden Zeit sollten Sie wenigstens die<br />
prinzipielle Funktionsweise dieser Geräte sowie ihre Bedienung kennenlernen. Sie werden<br />
diese Geräte im weiteren Verlauf des Praktikums benutzen.<br />
Seit dem Wintersemester 2002/2003 haben wir neue Versuchsaufbauten, bei denen die<br />
elektrischen Spannungssignale nicht mehr mit einem Oszilloskop aufgezeichnet werden,<br />
sondern mittels eines Analog-Digital Wandlers (AD-Wandler, CED = Cambridge Electronic<br />
Design) sofort in den Computer eingelesen werden. Ein speziell entwickeltes Programm<br />
(Spike II) zeigt dann auf dem Bildschrim des Monitors, ähnlich wie auf dem Bildschrim des<br />
Oszilloskops, den Verlauf der gemessenen Spannungen gegenüber der Zeit. Bis zu 8<br />
Kanäle können so am Computer gleichzeitig aufgezeichnet werden.<br />
Analog-Digital-Wandler<br />
Alle im Kurs zu analysierenden elektrophysiologischen Daten werden differentiell verstärkt.<br />
Der Ausgang des Differenzverstärkers liefert die gemessenen Spannungsänderungen als<br />
analoge Wellenform. Die Datenauswertung soll aber Computer gestützt erfolgen. Daher<br />
müssen die analog akquirierten Daten in einen binären Code übersetzt (digitalisiert) werden,<br />
um sie dann mit Hilfe eines PC einlesen, speichern <strong>und</strong> auswerten zu können. Hierzu wird<br />
im Kurs ein Analog-Digital-Wandler der Firma Cambridge Electronics Design (CED)<br />
verwendet. Mit Hilfe dieses Gerätes können auf 5 parallelen Kanälen (Ports 0 bis 4)<br />
gleichzeitig analoge in digitale Daten umgewandelt werden. Darüber hinaus besitzt das<br />
Gerät Trigger-Eingänge, um die Analog-Digital-Wandlung an ein externes Trigger Signal zu<br />
koppeln.<br />
Bei der Analog-Digital-Wandlung wird die kontinuierliche, analoge Wellenform mit einer<br />
bestimmten Rate (Sampling Rate) in digitale Datenpunkte übersetzt. Je höher die Sampling<br />
Rate, desto mehr digitale Datenpunkte pro Zeiteinheit werden verwendet, um den Verlauf<br />
der analogen Wellenform wiederzugeben. Trotzdem sollte die Sampling Rate nicht zu hoch<br />
eingestellt werden, da die Dateien dann zu viel Speicherplatz einnehmen. Ein guter<br />
Kompromiss <strong>für</strong> extrazelluläre Ableitungen liegt bei Sampling Raten von 10kHz.<br />
11
I. Differenzverstärker<br />
Die auftretenden Spannungsänderungen biologischer Signale sind sehr klein <strong>und</strong> müssen<br />
deshalb verstärkt werden. Bei intrazellulären Messungen, bei denen man mit einer Glasmikroelektrode<br />
in die Nervenzelle einsticht, mißt man die Differenz zwischen dem Potential<br />
innen (Zellinneres) <strong>und</strong> außen (Extrazellularraum bzw. Badflüssigkeit). Ist die Nervenzelle "in<br />
Ruhe", heißt das so gemessene Membranpotential "Ruhepotential". Für solche Messungen<br />
müssen sogenannte Gleichspannungsverstärker (auch DC- oder Mikroelektrodenverstärker)<br />
mit hohem Eingangswiderstand (warum?) benutzt werden. Solche <strong>für</strong> intrazelluläre<br />
Ableitungen geeigneten Verstärker lernen Sie dann kennen, wenn Sie sich zu<br />
einem Fortgeschrittenenpraktikum in der <strong>Neurobiologie</strong> entschließen.<br />
Alle Ableitungen, die in diesem Praktikum vorgenommen werden, sind extrazellulär. Anstatt<br />
Elektroden in einzelne Nervenzellen einzustechen, werden einzelne Nerven oder dicke<br />
Nervenstränge über Hakenelektroden aus Silber-, Kupfer- oder Stahldrähten gelegt <strong>und</strong> die<br />
extrazellulär auftretenden Spannungsänderungen gemessen. Diese Spannungsänderungen<br />
rühren von den Ionenflüssen her, die im extrazellulären Medium dann auftreten, wenn über<br />
die verschiedenen Axone eines Nervens Aktionspotentiale fortgeleitet werden. Gemessen<br />
wird die Summe aller zu einem Zeitpunkt auftretenden Spannungsänderungen, d.h. es<br />
handelt sich dabei um sog. Summenpotentiale. Die auftretenden Spannungsänderungen<br />
bei extrazellulären Ableitungen sind sehr klein (im Bereich von µV) <strong>und</strong> müssen deshalb oft<br />
bis 1000-fach verstärkt werden (Verstärkungsfaktoren gängiger Geräte: 10, 100, 1.000,<br />
10.000). Jede biologische Meßkette stellt dem Stromfluß eine Reihe von Widerständen<br />
entgegen, an denen Spannungen anliegen, z.B. Membranwiderstand, Elektrodenwiderstand<br />
<strong>und</strong> Eingangswiderstand des Meßgerätes.<br />
Gemessen werden kann die Spannung nur über R 2 (= Eingangswiderstand des Meßgerätes),<br />
sodaß es wünschenswert sein muß, daß U 2 möglichst groß <strong>und</strong> U 1 möglichst klein<br />
13
gehalten wird (U o ist ja die Spannung, welche die "biologische Batterie", die Nervenzelle,<br />
liefert <strong>und</strong> die wir messen wollen). Dies erreicht man dadurch, daß R 2 viel größer als R 1<br />
gemacht wird, denn es gilt:<br />
U o = U 1 + U 2 = U o . (R 1 /(R 1 +R 2 ) + R 2 /(R 1 +R 2 ))<br />
(siehe Hilfen Seite 26)<br />
Betrachtet man sich in der Formel die Brüche, so sieht man sofort,<br />
daß bei großem R 2 der erste Bruch R 1 /(R 1 +R 2 ) gegen Null <strong>und</strong> der zweite Bruch<br />
R 2 /(R 1 +R 2 ) gegen 1 geht.<br />
Da der Eingangswiderstand von Oszilloskopen oder dem Analogeingang des A/D Wandlers<br />
(dem Meßgerät, mit dem man Spannungsänderungen sichtbar machen kann) 1MΩ (10 6 Ω)<br />
ist, braucht man Verstärker, welche einen hohen Eingangswiderstand <strong>und</strong> einen niederen<br />
Ausgangswiderstand besitzen. Deshalb sagt man auch, daß die von uns benutzten<br />
Verstärker Impedanzwandler sind. Überlegen Sie sich, was passieren würde, wenn Sie die<br />
biologische Spannung direkt mit dem Oszilloskop ohne Vorschaltung eines Verstärkers<br />
messen wollten (R 1 = 100 MΩ Membranwiderstand + Elektrodenwiderstand, R 2 = 1MΩ<br />
Eingangswiderstand Oszilloskop).<br />
Im Praktikum wird ein sogenannter differentieller AC-Verstärker benutzt, bei dem man zwei<br />
Hakenelektroden (U 1 <strong>und</strong> U 2 ) benutzt, die in den + <strong>und</strong> - Eingang des Verstärkers führen.<br />
Läuft nun ein Aktionspotential über die beiden Hakenelektroden, erhält man als<br />
Ergebnis ein sog. biphasisches Potential<br />
<strong>und</strong> man sagt auch, man mache eine bipolare Ableitung. Benutzt man nur eine Hakenelektrode,<br />
wird der Eingang des Verstärkers auf Masse gelegt (geerdet), so führt man eine<br />
monopolare Ableitung durch <strong>und</strong> erhält ein monophasisches Potential<br />
14
Jeder Verstärker braucht ein Bezugspotential, relativ zu dem alle anderen Potentiale<br />
bestimmt werden: die sogennannte Erde oder Masse. In der Technik werden fast alle<br />
Spannungen gegenüber der tatsächlichen Erde erzeugt <strong>und</strong> gemessen. Das wird im<br />
Versuch realisiert, indem alle Geräte <strong>und</strong> das Präparat auf einen gemeinsamen Erdpunkt<br />
gelegt werden.<br />
Bedingt durch die hochempfindlichen Meßeinrichtungen treten eine Reihe von Störungen bei<br />
den elektrophysiologischen Ableitungen auf, die von anderen elektromagnetischen Quellen<br />
kommen <strong>und</strong> die die Messungen beeinträchtigen. Die Kursräume sind erfüllt von elektromagnetischen<br />
Wechselfeldern hoher (Radiosender) <strong>und</strong> niedriger (Lichtnetz) Frequenzen,<br />
die in allen Leitern, also auch in den Meßleitungen <strong>und</strong> im biologischen Präparat, Wechselspannungen<br />
erzeugen. Solche Spannungen überlagern als "hochfrequentes Rauschen" (HF)<br />
bzw. "Netzbrumm" (50 Hz Wechselstrom) das biologische Signal, das dem Verstärker zugeführt<br />
wird. Weniger aufwendig, als den ganzen Versuchsaufbau in einen Faradaykäfig zu<br />
stellen, ist es, die Meßleitungen abzuschirmen <strong>und</strong> die Abschirmung mit den Gehäusen der<br />
Meß- <strong>und</strong> Reizgeräte, welche ja geerdet sind, zu verbinden. Die trotz der Abschirmung<br />
eingestreuten hochfrequenten Störsignale können durch den im Vorverstärker eingebauten<br />
Tiefpaßfilter weggefiltert werden (Aktionspotentiale werden in ihrer Form kaum verfälscht,<br />
wenn Frequenzen > 10 kHz herausgefiltert werden). Ebenso können auch im unteren<br />
Bereich störende Frequenzen herausgefiltert werden (z.B. < 100 Hz). Durch die Kombination<br />
von Hochpaß- <strong>und</strong> Tiefpaßfilter erhält man einen Bandpaßfilter, der Frequenzen nur innerhalb<br />
des eingestellten Bereiches durchläßt.<br />
Die niederfrequenten 50 Hz Störsignale aus dem Lichtnetz sind oft so stark, daß sie durch<br />
Filter allein nicht beseitigt werden können. Es muß dann differentiell abgeleitet werden, wenn<br />
man nicht in einem Faradaykäfig arbeiten kann (der wie eine große Abschirmung wirkt).<br />
Für den Differenzverstärker gilt also (siehe auch Abb. 4):<br />
U 1 - U 2 = U o (Ausgangsspannung, welche mit dem Oszilloskop aufge-<br />
zeichnet wird)<br />
15
Liegt auf beiden Hakenelektroden die Störung Br (<strong>für</strong> "Brumm") dann gilt:<br />
(U 1 + U Br ) - (U 2 + U Br ) = U o (U Br hebt sich auf, d.h. der "Brumm" wird eliminiert).<br />
Erfolgreiche Ableitungen lassen sich aber nur dann durchführen, wenn gilt U 1 U 2 , d.h. das<br />
zu messende Signal (das Aktionspotential) darf nicht gleichzeitig an U 1 <strong>und</strong> U 2 anliegen.<br />
Praktischerweise muß es also zwischen beiden Haken einen Abstand geben.<br />
16
Abb. 4: - Ableitbedingungen<br />
a) Monopolare Ableitung gegenüber Erde; der Brumm wird verstärkt<br />
b) Differentielle Ableitung; der Brumm wird eliminiert.<br />
Da die Stromflüsse um Hakenelektroden sehr komplex sein können, kann man auch öfters<br />
tri- <strong>und</strong> mehrphasische Potentiale erhalten. Man kann zwar theoretisch ableiten, warum es<br />
zu bestimmten Potentialformen kommt, da aber außer den oben genannten Randbedingungen<br />
noch andere Variablen von Bedeutung sind (z.B. der Zustand des Präparats, die<br />
17
Feuchtigkeit in der Umgebung der Ableitstelle, die Lage der indifferenten Elektrode, die<br />
Übergangswiderstände an den beiden differenten Elektroden), ist es häufig schwierig, im<br />
Experiment einzusehen, warum ein Potential bi- oder triphasisch ist. Unter scheinbar<br />
gleichen Ableitbedingungen treten deshalb im Praktikum alle möglichen Potentialformen auf.<br />
Wir wollen deshalb immer dann von einem extrazellulären Aktionspotential sprechen, wenn<br />
eine abgeleitete Potentialform möglichst reproduzierbar auftritt <strong>und</strong> in der Höhe nicht<br />
graduiert ist (mit Ausnahme von zufällig gleichzeitig auftretenden Signalen, die dann<br />
summiert werden, d.h. die Amplitude ist dann größer).<br />
II. Reizgerät (Stimulus Generator)<br />
Es liefert rechteckige Spannungspulse, deren Amplitude ("Volts"), Dauer ("Duration"),<br />
Frequenz ("Frequency") <strong>und</strong> Polarität ("Polarity") variiert werden können.<br />
Gleichzeitig mit den Rechteckpulsen erzeugt das Gerät sehr kurze (wenige µs lange),<br />
nadelförmige Pulse konstanter Amplitude (> 10 V), die als Triggersignale ("Auslösesignale")<br />
dienen können. So kann zum Beispiel der Strahlenüberlauf auf dem Oszilloskopschirm durch<br />
diese Pulse extern getriggert werden. Es gibt zwei Arten solcher Triggerpulse: "Pulse" <strong>und</strong><br />
"Prepulse". Der Triggerpuls "Pulse" kommt zeitgleich mit dem Rechteckpuls am Ausgang an,<br />
der "Prepulse" kommt vorher. Dabei kann der zeitliche Abstand zwischen dem "Prepulse"<br />
<strong>und</strong> dem "Pulse" mit dem Knopf "Delay" variiert werden. Man kann damit also zum Beispiel<br />
erreichen, daß der Oszilloskopstrahl einige ms vor dem Rechteckpuls (= Reiz) losläuft <strong>und</strong><br />
die Reizantwort auf der Mitte des Bildschirms dargestellt wird.<br />
Bei Doppelpulsen ("Twin Pulses") erscheint ein zusätzlicher Rechteckpuls am Ausgang, <strong>und</strong><br />
zwar synchron zum "Prepulse", so daß nun am Ausgang zwei Pulse erscheinen, deren<br />
Abstand mit "Delay" verändert werden kann (Abb. 5).<br />
18
Abb. 5:<br />
19
III. Analog-Digital Wandler<br />
Um die analogen Signale aus dem Differenzverstärker direkt in den Computer einlesen zu<br />
können, müssen sie digitalisiert werden. Dies bewerkstelligt der Analog-Digital (AD-)<br />
Wandler vom Cambrige Electronic Design (CED).<br />
Um Ihnen trotz der Benutzung eines AD-Wandlers <strong>und</strong> des SPIKE2 Programms am<br />
Computer auch noch die Gr<strong>und</strong>begriffe eines Oszilloskops zu erklären, reproduzieren wir die<br />
folgengen Seiten aus dem alten Versuchsskript:<br />
IV. Oszilloskop<br />
Dieses Gerät dient zur Registrierung sehr schneller Potentialänderungen <strong>und</strong> man muß<br />
zwischen Analog- oder Digital-Geräten unterscheiden. Herzstück ist die Kathodenstrahlröhre<br />
(Abb. 1). Von der Kathode (1) wird ein Elektronenstrahl emittiert <strong>und</strong> von zwei Anoden (2<br />
<strong>und</strong> 3) beschleunigt <strong>und</strong> fokussiert. Anschließend können zwei gegeneinander senkrecht<br />
angebrachte Plattenpaare (4 <strong>und</strong> 5) den Strahl horizontal <strong>und</strong> vertikal ablenken. Schließlich<br />
trifft der Strahl auf einen Fluoreszenzschirm <strong>und</strong> wird dadurch sichtbar gemacht. Der Schirm<br />
ist horizontal in 10 Einheiten ("divisions") <strong>und</strong> vertikal in 8 Einheiten aufgeteilt.<br />
Abb. 1: Schema einer Kathodenstrahlröhre. 1: Kathode zur Emission von Elektronen; 2:<br />
Anode zur Beschleunigung; 3: Anode zur Bündelung (Fokussierung) des Elektronenstrahl; 4:<br />
horizontal ablenkendes Plattenpaar (liefert die "Zeitbasis"); 5: vertikal ablenkendes Plattenpaar<br />
(erhält die Meßspannung); 6: Fluoreszenzschirm.<br />
20
Der Elektronenstrahl vermag (da quasi trägheitsfrei) schnellen Potentialänderungen an den<br />
ablenkenden Plattenpaaren (bis in den MHz-Bereich) leicht zu folgen. Dadurch erreicht das<br />
Oszilloskop eine sehr hohe zeitliche Auflösung, welche es zur Darstellung elektrophysiologischer<br />
Signale (z.B. postsynaptische Potentiale, Aktionspotentiale) geeignet macht.<br />
Legt man an das horizontal ablenkende Plattenpaar eine zeitlich linear ansteigende<br />
Spannung (Abb. 2a), so wandert der Elektronenstrahl mit einer konstanten Geschwindigkeit<br />
von links nach rechts über den Schirm.<br />
Abb. 2: a-c: Zeitlicher Verlauf der Spannung am horizontal ablenkenden Plattenpaar bei<br />
verschiedenen Triggerungsmodi.<br />
a) linearer Spannungsanstieg von U l (Strahl am linken Bilschirmrand) nach U r (Strahl am<br />
rechten Bildschirmrand). b) Sägezahnspannung bei automatischer Triggerung. c)<br />
Spannungsverlauf bei line-Triggerung. d) Meßsignalverlauf; sobald das Meßsignal einen<br />
bestimmten Spannungswert über- oder unterschreitet, wird der Strahlenüberlauf ausgelöst<br />
(interne Triggerung).<br />
Legt man gleichzeitig die Meßspannung an das vertikal ablenkende Plattenpaar, kann diese<br />
in ihrem zeitlichen Verlauf auf dem Schirm dargestellt werden. Es gibt nun mehrere Möglichkeiten<br />
<strong>für</strong> das Auslösen dieses linearen Spannungsanstiegs am horizontalen Plattenpaar<br />
<strong>und</strong> damit des Überlaufs des Strahls über den Schirm (Triggern)<br />
Die folgende Beschreibung ist auf ein einfaches Analoggerät, zum Beispiel Philips PM3233,<br />
zugeschnitten:<br />
21
Abb.3:<br />
22
a) automatische Triggerung (AUTO): ein vom Oszilloskop intern erzeugtes Signal startet<br />
den linearen Spannungsanstieg an den horizontal ablenkenden Platten <strong>und</strong> damit den<br />
Überlauf des Strahls. Sobald die Spannung einen bestimmten Wert U r erreicht hat <strong>und</strong> der<br />
Strahl am rechten Bildschirmrand angekommen ist, wird die Spannung blitzartig auf den<br />
Ausgangswert U l zurückgesetzt, so daß der Strahl zum linken Bildschirmrand zurückspringt.<br />
Sodann beginnt der lineare Spannungsanstieg von neuem. Auf diese Weise liegt am horizontal<br />
ablenkenden Plattenpaar eine sog. Sägezahnspannung (Abb. 2b) an. Eingeschaltet<br />
wird dieser Trigger-Modus durch Drücken des Knopfes "AUTO TRIG".<br />
Anwendung: Darstellung periodischer Signale, die über längere Zeit andauern; Messung<br />
zeitlich konstanter Spannungswerte (z.B. Messung des Ruhepotentials); kontinuierliche<br />
Darstellung von Ereignissen.<br />
b) mains-Triggerung (oft auch Line): die 50 Hz-Wechselspannung des 220 V-Stromnetzes<br />
stellt die Starterpulse <strong>für</strong> den Überlauf des Strahls im Abstand von 20 ms (= 1/(50<br />
Hz)) zur Verfügung (Abb. 2c). Sobald der Strahl nach einem Überlauf wieder an den linken<br />
Bildschirmrand zurückgesprungen ist, löst der nächste von der Netzspannung abgeleitete<br />
Impuls einen erneuten Überlauf aus. Durch Drücken des Knopfes "LINE" wird dieser Trigger-<br />
Modus eingeschaltet.<br />
c) interne Triggerung: das Meßsignal selbst löst den Überlauf des Strahls aus, sobald es<br />
einen bestimmten, am "Trigger Level" einstellbaren Spannungswert überschreitet (Taste +<br />
gedrückt) oder unterschreitet (Taste - gedrückt, Abb. 2d). Mit Hilfe der Knöpfe A <strong>und</strong> B<br />
bestimmt man, ob das Meßsignal des linken (A) oder des rechten (B) Kanals zur Triggerung<br />
dienen soll.<br />
Anwendung: Darstellung periodischer Signale; Darstellung solcher Signale, deren zeitliches<br />
Auftreten nicht vorhersagbar ist (z.B. Untersuchung von Nervenimpulsmustern beim Streckrezeptor<br />
der Heuschrecke).<br />
d) externe Triggerung (EXT): ein externes Signal, über die Buchse "TRIG" eingespeist,<br />
löst den Überlauf des Strahls aus.<br />
Anwendung: Darstellung von Signalen, die durch eine Reizung (Startpuls) generiert werden<br />
(z.B. Darstellung von Aktionspotentialen beim Regenwurmversuch).<br />
Die Geschwindigkeit des Strahlenüberlaufs wird mit dem Drehschalter an der Zeitbasis des<br />
Oszilloskops ("TIME/cm, oft auch TIME/Div) eingestellt (Bereich 0.2 µs/cm bis 5 s/cm). Die<br />
Angaben auf der Skala stimmen nur dann, wenn der innere dunkelblaue Drehknopf im Uhrzeigersinn<br />
bis zum Anschlag gedreht worden ist (Calibrier- oder Eichknopf).<br />
23
Die vertikale Auslenkung des Strahls geschieht in der Regel durch das Meßsignal. Im allgemeinen<br />
muß dieses Signal, bevor es durch die Kathodenstrahlröhre sichtbar gemacht<br />
werden kann, verstärkt werden. Die zur Verfügung stehenden Oszilloskope besitzen zwei<br />
unabhängige Verstärker (linker <strong>und</strong> rechter Verstärker). Der Verstärkungsfaktor eines jeden<br />
Verstärkers kann an einem Drehknopf (VOLTS/cm, oft auch VOLTS/Div) in einem Bereich<br />
von 2 mV/cm bis 10 V/cm eingestellt werden. Auch hier sollte der innere dunkelblaue Drehknopf<br />
am rechten Anschlag stehen.<br />
Das Meßsignal kann auf zwei verschiedene Arten dem Verstärker zugeführt werden, nämlich<br />
über Gleichspannungskopplung (DC-coupling) oder über Wechselspannungskopplung (ACcoupling),<br />
einstellbar über den Schalter "DC" <strong>und</strong> "AC". Bei der Gleichstromkopplung ist der<br />
Signaleingang direkt mit dem Verstärker verb<strong>und</strong>en, <strong>und</strong> das Signal wird linear verstärkt <strong>und</strong><br />
angezeigt. Bei der Wechselstromkopplung ist der Eingang kapazitiv (d.h. über einen<br />
Kondensator) mit dem Verstärker verb<strong>und</strong>en. Dadurch werden Gleichspannungsanteile des<br />
Signals (Offset) unterdrückt, <strong>und</strong> nur genügend schnelle Spannungsänderungen (ab 1 Hz)<br />
werden angezeigt. Wenn der Schalter auf O (<strong>für</strong> Gro<strong>und</strong>, GND) steht, wird das Meßsignal<br />
vom Eingang des Verstärkers abgekoppelt <strong>und</strong> der Eingang geerdet. Die vertikale Lage des<br />
Strahls wird in diesem Fall durch das Eingangssignal nicht beeinflußt.<br />
Die Drehknöpfe "Y-POSITION" regeln die vertikale Ausgangsposition des Strahls. Der Drehknopf<br />
an der Zeitbasis (X-Position) dient der horizontalen Verschiebung, <strong>und</strong> die Knöpfe an<br />
den Eingangsverstärkern dienen der vertikalen Verschiebung des Strahls.<br />
Digitalgeräte, die auch im Praktikum vorhanden sind, funktionieren prinzipiell gleich, die<br />
Daten werden aber wie beim AD-Wandler digitalisiert. Die Güte der Abbildung der<br />
Spannungssignale hängt dabei von der "sampling-rate" ab (wie viele Punkte pro Zeiteinheit).<br />
Im Gegensatz zu Analoggeräten werden bei Digitalgeräten die Amplituden von schnell aufeinander<br />
folgenden Aktionspotentialen wegen einer zu geringen "sampling-rate" nicht immer<br />
in voller Höhe aufgezeichnet. Dies kann ein echter Nachteil eines Digitalgerätes sein.<br />
Überprüfung der Genauigkeit des Oszilloskops<br />
Die Erfahrung zeigt immer wieder, daß Geräte - egal, ob neu, ob viel oder wenig benutzt -<br />
ungenau arbeiten. Man muß sich deshalb vor ihrer Verwendung überlegen, welche Meßgenauigkeit<br />
<strong>für</strong> die geplante Untersuchung nötig ist <strong>und</strong> ob das Gerät laut Angabe des<br />
Herstellers hinreichend genau ist.<br />
24
Um die Genauigkeit der Strahlenüberlaufgeschwindigkeit zu überprüfen, verwenden wir den<br />
in das Oszilloskop eingebauten "Calibrator", an dessen Ausgang eine Rechteckspannung<br />
erhältlich ist. Je nach Typ ist dieses Eichsignal verschieden, z.B. <strong>für</strong> das Philips Oszilloskop<br />
ist die Frequenz 2000 Hz <strong>und</strong> die Amplitude 600 mV. Die Überlaufgeschwindigkeit wird in<br />
geeigneter Weise möglichst genau eingestellt. Durch interne Triggerung läßt sich ein<br />
"Stehendes Bild" erzeugen. Die gemessene Periodendauer wird mit der erwarteten<br />
verglichen.<br />
Darstellung von elektrischen Wechselfeldern<br />
Ein Vertikalverstärker am Oszilloskop wird auf 1 mV/div eingestellt <strong>und</strong> ein nicht abgeschirmtes<br />
Kabel an eine Eingangsbuchse angeschlossen, um im Raum vorhandene<br />
elektrische Wechselfelder ("Brumm") darzustellen. Um den Einfluß einer Abschirmung des<br />
Kabels zu demonstrieren, wird der gleiche Versuch mit einem abgeschirmten Kabel<br />
(Koaxialkabel) wiederholt. Sollten Sie ein Tektronix Digitaloszilloskop benutzen, dann<br />
schließen Sie nun zwei nicht abgeschirmte, etwa gleichlange Kabel an die beiden Eingänge<br />
des Verstärkers des digitalen Oszilloskops an. Der "Brumm" wird zunächst bei Erdung<br />
jeweils eines Eingangs registriert (entspricht monopolarer Ableitung) <strong>und</strong> seine Reduzierung<br />
durch gleichzeitige Verwendung beider Eingänge demonstriert (entspricht bipolarer<br />
Ableitung). Halten Sie die beiden Kabel in verschiedene Richtungen zueinander. Beobachtung?<br />
Ein Differenzverstärker verstärkt die an seinen beiden Eingängen anliegenden<br />
Spannungsdifferenzen. Der mit dem Minuszeichen versehene Eingang kehrt die Polarität<br />
des Signals um.<br />
25
Unter den Bedingungen der neuen Versuchsapparatur (AD-Wandler <strong>und</strong> SPIKE2 Programm<br />
am Computer) können Sie den Versuch auch durchführen, wenn Sie ein entsprechendes<br />
Kabel an die Eingangsbuchsen (Input) des Differenzverstärkers legen. Lassen Sie sich vom<br />
Tutor helfen.<br />
Hilfen<br />
Ohmsches Gesetz: U = I . R, wobei U = Spannung, I = Strom <strong>und</strong><br />
einem geschlossenen Stromkreislauf sind.<br />
R = Widerstand in<br />
Für Abb. 6a gilt:<br />
U 1 bzw. U 2 sind dabei die über den Widerständen R 1 bzw. R 2 abfallenden Spannungen.<br />
26
Abb. 6:<br />
a) Einfacher Stromkreis zum Ohmschen Gesetz.<br />
b) Stromkreis mit Widerstand (R) <strong>und</strong> Kondensator (C)<br />
Für den Gesamtwiderstand R ges bei n in Serie geschalteten Widerständen gilt:<br />
R ges = R 1 + R 2 + ... + R n<br />
Für den Gesamtwiderstand R ges bei n parallel geschalteten Widerständen gilt:<br />
1/R ges = 1/R 1 + 1/R 2 + ... + 1/R n<br />
Aufladen eines Kondensators (C): Nach Schließen des Schalters (S) in Abb. 6b gilt <strong>für</strong> den<br />
Stromfluß I <strong>und</strong> <strong>für</strong> die über dem Widerstand R abfallende Spannung U R :<br />
I(t) = I o . exp(-t/RC), U R (t) = U o . (1 - exp(t/RC) mit I o = U/R <strong>und</strong> t = Zeit.<br />
Einige Gerätedaten:<br />
Eingangswiderstand des Oszilloskops: 1 MΩ<br />
Eingangskapazität des Oszilloskops: 47 pF<br />
27
Das Ruhemembranpotential<br />
In Ruhe, d.h. wenn keine Aktionspotentiale ablaufen, zeigt eine Nervenzelle gegenüber dem<br />
sie umgebenden Milieu ein negatives Ruhemembranpotential (meist zwischen -100 <strong>und</strong> –<br />
40mV), d.h. das Zellinnere ist gegenüber Außen negativ geladen. Dies beruht größtenteils<br />
auf einer ungleichen Ionenverteilung (vergl. Tabelle). Wie wir sehen werden, ist besonders<br />
der Unterschied der K + -Konzentration von Bedeutung, wobei diese üblicherweise intrazellulär<br />
deutlich höher ist als extrazellulär (Ausnahme: Endolymphe im Innenohr).<br />
Tabelle: Ionale Zusammensetzung des extra- <strong>und</strong> intrazellulären Milieus beim Tintenfisch-<br />
Riesenaxon:<br />
Ionenart Intrazellulär (mM) Extrazellulär (mM) Gleichgewichtspotential<br />
K + 400 20 -75 mV<br />
Na + 50 440 +55 mV<br />
Cl - 52 560 -60 mV<br />
A - 385 - -<br />
Die selektive Leitfähigkeit der Zellmembran <strong>für</strong> K + -Ionen lässt K + , also positive Ladungen,<br />
entlang seines Konzentrationsgradienten solange aus der Zelle strömen, bis die durch die<br />
Ladungsverschiebung erzeugte Spannungsdifferenz einen weiteren Ausstrom stoppt. Es<br />
einsteht ein elektrochemisches Gleichgewicht. Betrachtet man jede Ionenart <strong>für</strong> sich allein,<br />
so lässt sich mit Hilfe der Nernst-Formel das sich einstellende Gleichgewichtspotential (E)<br />
berechnen:<br />
E x = (R*T) / (z*F) * ln([X a ]/[X i ])<br />
Dabei ist R = 8,315 J*K -1 *mol -1 die Gaskonstante, T die absolute Temperatur in Kelvin (0°C =<br />
273 K), F = 9,648*10 4 C*mol -1 die Faradaykonstante, z die Ladung des Ions, X a <strong>und</strong> X i die<br />
entsprechenden Ionenkonzentration außen bzw. innen. Für K + ergibt sich bei 20°C ein<br />
Nernst-Potential (E K ) von -75mV. Man rechne einmal nach.<br />
Daneben ist die Membran in Ruhe, wenn auch in geringerem Maße, zusätzlich <strong>für</strong> andere<br />
Ionen leitfähig. Für Natrium ergibt sich z.B. aufgr<strong>und</strong> seines entgegengesetzten Konzentrationsgradienten<br />
ein entgegengerichtetes Nernst-Potential (hier E Na = +55mV), welches zu<br />
einem letztendlich leicht positiverem Ruhemembranpotential führt <strong>und</strong> im Verlauf eines<br />
Aktionspotentials die Umpolung der Membran bewirkt. Alle Ionenarten gleichzeitig, ihre<br />
28
Konzentrationsverhältnisse <strong>und</strong> spezifischen Permeabilitäten durch die Membran, berücksichtigt<br />
die Goldmann-Hodgkin-Katz Gleichung:<br />
p K [K + ] a + p Na [Na + ] a + p Cl [Cl - ] i<br />
E m = (R*T) / F * ln ---------------------------------------------------<br />
p K [K + ] i + p Na [Na + ] i + p Cl [Cl - ] a<br />
(Rechnerisch lassen sich <strong>für</strong> pK, pNa, pCl die Relationen (z.B. 1:0,04:0.25) verwenden).<br />
Aktionspotentiale<br />
Spannungsänderungen im dendritischen Eingangsbereich einer (Sinnes-) Nervenzelle, ausgelöst<br />
z.B. durch synaptische Ströme oder einen physikalischen Reiz, führen wenngleich mit<br />
einer von der Entfernung abhängigen Abnahme (Dekrement) zu Spannungsänderungen an<br />
der entfernt liegenden spike-generierenden Zone (Axonhügel), wo eine hohe Dichte<br />
spannungsaktivierter Ionenkanäle die Transformation des bis dahin graduierten Potentials<br />
in Aktionspotentiale bewirkt. Erreicht das Membranpotential hier einen spezifischen<br />
Schwellenwert, so öffnen sich spannungsabhängige Natriumkanäle. Einströmende positive<br />
Na + -Ionen depolarisieren die Membran weiter, so daß sich noch mehr spannungsaktivierte<br />
Kanäle öffnen, der Prozeß eskaliert. Hierbei ändern sich die Permeabilitätsverhältnisse<br />
kurzfristig stark zugunsten von Natrium, <strong>und</strong> nach Goldmann nähert sich das Membranpotential<br />
dem Ausgleichspotential von Natrium (E Na ) an. Eine depolarisierte Membran führt<br />
dann wieder zur schnellen Inaktivierung der Na + -Kanäle. Nach transientem Na + -Einstrom<br />
schließen sich die Kanäle wieder, der transiente Na + -Strom hört auf. Gleichzeitig öffnen<br />
vergleichsweise langsamer reagierende spannungsaktivierte K + -Kanäle. Ausströmendes K +<br />
bringt die Zellmembran wieder auf ein negatives Potential zurück (Repolarisation), bei<br />
welchem die K + -Kanäle wieder schließen. Solange noch nicht alle spannungsabhängien K + -<br />
Kanäle wieder geschlossen sind, kann das resultierende Permeabilitätsverhältnis das<br />
Membranpotential sogar weiter Richtung E K verschieben – es kommt zu einer Nachhyperpolarisierung.<br />
Eine sehr kurze Erregung wird vielleicht nur ein einziges Aktionspotential auslösen, die<br />
Repolarisation bringt das Membranpotential dann wieder auf den Ruhewert. Langanhaltende<br />
Erregung durch andauernde, postsynaptische Transmitterwirkung führt jedoch zu einem<br />
kontinuierlichen depolarisierenden (Ionen-) Einstrom. Je nach Stärke der Erregung <strong>und</strong> dem<br />
29
daraus resultierenden Strom, depolarisiert die Membran wieder mehr oder weniger schnell<br />
überschwellig <strong>und</strong> das nächste Aktionspotential wird ausgelöst. Es entsteht eine Folge von<br />
Aktionspotentialen, deren Frequenz direkt von der Stärke der Depolarisierung, z.B. durch<br />
einen stärkeren Reinz in Rezeptoren, abhängt (Frequenzkodierung). Die Entladungsfrequenz<br />
lässt sich allerdings nicht beliebig steigern. Begrenzt durch die Dauer eines<br />
einzelnen Aktionspotentials, welches meist mehr als 2 ms braucht, um vollständig abzulaufen,<br />
liegen die maximalen Entladungsfrequenzen meist unter 500 Hz. Jedem Aktionspotential<br />
folgt eine Refraktärzeit, in der auch bei noch so hoher Depolarisation die noch<br />
inaktivierten Na + -Kanäle nicht erneut öffnen können, sondern erst durch genügend starke<br />
Repolarisation wieder in einen aktivierbaren Zustand übergehen müssen. Während der<br />
absoluten Refraktärzeit ist kein weiteres Aktionspotential auslösbar. Die relative<br />
Refraktärzeit bestimmt hingegen den darauf folgenden Zeitraum, in dem die Schwelle zur<br />
Auslösung höher liegt <strong>und</strong> die Aktionspotentialamplitude noch nicht den höchsten Wert<br />
erreicht. Daneben können weitere spannungsabhängige Ionenkanäle, welche während <strong>und</strong><br />
zwischen Aktionspotentialen aktivieren bzw. inaktivieren das Entladungsverhalten<br />
modulieren (wie z.B. Ca 2+ -abhängige <strong>und</strong> transiente K + -Kanäle).<br />
Passive Erregungsleitung<br />
Passive elektrische Eigenschaften von Membranen spielen <strong>für</strong> die Erregungsfortleitungsgeschwindigkeit<br />
(z.B. im Axon) bzw. Erregungsintegration (z.B. im dendritischen Bereich)<br />
eine grosse Rolle. Sie lassen sich durch einfache elektrische Modelle beschreiben. Diese<br />
reduzieren die biologischen Vorgänge auf Schaltkreise aus Widerständen, Kondensatoren<br />
<strong>und</strong> Stromquellen. Um diese Vorgänge zu verstehen, müssen Sie sich vor allem das<br />
Ohm'sche Gesetz klar machen (U = R • J). Werden über Membranen<br />
Spannungsänderungen induziert, etwa durch synaptische Ströme oder Strominjektionen, so<br />
ändert sich das Membranpotential mit einer gewissen Zeitverzögerung <strong>und</strong> breitet sich unter<br />
Amplitudenverlust entlang der Membran aus.<br />
30
Ein sehr kurzer Abschnitt einer Nervenzelle kann durch die folgende Schaltung simuliert<br />
werden:<br />
Aussen<br />
Stromgenerator<br />
r m<br />
c<br />
V m<br />
I m<br />
Innen<br />
V m ist das Membranpotential zu einem beliebigen Zeitpunkt. r m ist der Membranwiderstand<br />
<strong>und</strong> c m die Membrankapazität. Fließt ab einem bestimmten Zeitpunkt ein konstanter Strom I<br />
durch die Membran, so ändert sich das Membranpotential nicht sofort, sondern der Zeitverlauf<br />
der Potentialänderung folgt aufgr<strong>und</strong> der Kondensatoreigenschaften der Zellmembran<br />
einer Exponentialfunktion: V m (t) = I * R * (1-e - t/τ ). Dieses Zeitverhalten der<br />
Membran wird durch die Zeitkonstante (τ m ) der Membran bestimmt:<br />
τ m<br />
= r m<br />
. c m<br />
Je größer r m oder c m sind, desto länger dauert es bis das Membranpotential infolge eines<br />
Stromflusses einen neuen Wert erreicht.<br />
Die räumliche Ausbreitung einer Spannungsänderung, z.B. entlang eines Dendriten, lässt<br />
sich durch folgende etwas komplexere Schaltung simulieren. In diesem Modell werden die<br />
Kabeleigenschaften eines zylindrischen Abschnittes einer Nervenzelle dargestellt, indem der<br />
Zylinder in diskrete Abschnitte eingeteilt wird. Jedem Abschnitt wird ein Membranwiderstand,<br />
eine Membrankapazität <strong>und</strong> um Inneren der Zelle ein Längswiderstand zugeordnet.<br />
31
m ist der Membranwiderstand eines Einheitsabschnittes eines solchen Zylinders, c m die<br />
Membrankapazität <strong>und</strong> r i der Längswiderstand des Inneren eines solchen Abschnittes. Wird<br />
in einem zylindrischen Abschnitt einer Zelle eine Spannungsänderung durch einen Strom<br />
induziert, so breitet sich diese elektrotonisch entlang des Zylinders aus. Da pro Einheitsabschnitt<br />
nun ein Teil des Stroms über die Membran in den extrazellulären Raum abfließt,<br />
steht <strong>für</strong> den nächsten benachbarten Abschnitt ein geringerer Strom zu Verfügung, um eine<br />
Spannungsänderung zu induzieren. Die Potentialänderung zeigt daher eine exponentielle<br />
Amplitudenabnahme entlang des Zylinders.<br />
Folgende Gleichung beschreibt den exponentiellen Spannungsabfall der ursprünglichen<br />
Spannung (V 0 ) über die Distanz x: V x = V 0 * e -x/λ<br />
Die Längskonstante (λ)<br />
eines zylindrischen Zellabschnitts bestimmt das Dekrement der Amplitude in Längsrichtung.<br />
Je größer das Verhältnis von r m zu r i<br />
ist, desto größer ist also die Spannungsänderung in<br />
einem bestimmten Abstand vom Ort der Strominjektion (z.B. des postsynaptischen<br />
Stromes). Bezogen auf die Zellfortsätze einer Nervenzelle ist demnach eine gute<br />
Membranisolierung (r m gross) bei gleichzeitig geringem cytoplasmatischen<br />
Innenlängswiderstand (r i klein, z.B. bei großem Axondurchmesser) förderlich <strong>für</strong> eine<br />
möglichst weitreichende verlustarme elektrotonische Ausbreitung von Potentialen.<br />
32
1. Versuchstag:<br />
Extrazelluläre Ableitung von Aktionspotentialen eines identifizierten Neurons vom<br />
Bauchmark der Wanderheuschrecke<br />
Am heutigen Kurstag werden Sie in die Lage eines Neurowissenschaftlers versetzt, der<br />
aufgr<strong>und</strong> experimentellen Vorgehens Erkenntnisse über sein Objekt sammelt. Dazu werden<br />
Sie vom Halskonnektiv extrazellulär Aktionspotentiale eines Neurons ableiten.<br />
Das Vorgehen wird Ihnen erheblich erleichtert, wenn Sie sich im weiteren konsequent an<br />
das Skript halten <strong>und</strong> sich bei Fragen an den/die Tutor/in wenden.<br />
Ein wesentlicher Vorteil der Invertebraten <strong>für</strong> neurophysiologische Untersuchungen ist, daß<br />
einzelne Neurone nach physiologischen <strong>und</strong> morphologischen Gesichtspunkten als Individuen<br />
identifiziert werden können. In diesem Versuch werden Sie von einem solch identifizierten<br />
Neuron extrazellulär aus einem der beiden Konnektive ableiten können. In diesen<br />
Konnektiven verlaufen die Axone von mehreren tausend Neuronen. Aufgr<strong>und</strong> der unterschiedlichen<br />
Größe der Aktionspotentiale <strong>und</strong> des spezifischen Antwortverhaltens lassen<br />
sich bei der extrazellulären Ableitung einzelne Neurone oder Gruppen von Neuronen identifizieren.<br />
Man unterscheidet zwischen aufsteigenden Neuronen, die Information von posterior<br />
nach anterior gelegenen Ganglien weitergeben, <strong>und</strong> absteigenden Neuronen, die<br />
Information nach posterior übertragen. Ihre Aufgabe wird es sein, durch das Verabreichen<br />
qualitativ verschiedener Reize zu untersuchen, ob sich an dem vorgegebenen Ableitort<br />
Aktionspotentiale mit hoher Amplitude sich mit einem bestimmten Reiz korellieren lassen. In<br />
der Regel stammen Potentiale gleicher Amplitude von den gleichen Neuronen. Es wird dabei<br />
auch möglich sein, einige Details über die integrativen Eigenschaften eines solchen Neurons<br />
(Antwortverhalten, rezeptives Feld, Verschaltung, Lage im ZNS) zu erfahren.<br />
Abbildung: Die Abbildung (a) zeigt eine schematische Zeichnung des "Strickleiter"-Nervensystems<br />
vom Kopf <strong>und</strong> Thorax einer Wanderheuschrecke (Gehirn <strong>und</strong> Ganglion). Eingezeichnet<br />
ist die morphologische Struktur ("Gestalt") zweier identifizierter Neurone: DCMD:<br />
descending contralateral movement detector <strong>und</strong> LGMD: lobular giant movement detector.<br />
In (b) ist dargestellt, daß jedes vom Konnektiv abgeleitete Aktionspotential des DCMD (unter<br />
Spur) ein erregendes postsynaptisches Potential (EPSP = exzitatorisches postsynaptisches<br />
Potential) in einem Motorneuron (FETi, obere Spur) hervorruft. Das FETi-Motorneuron ist<br />
das schnelle Motorneuron des Sprungmuskels des Wanderheuschrecke (FETi = fast extensive<br />
tibiae motorneurone).<br />
33
Präparation (Halskonnektiv)<br />
Eine durch Kühlung betäubte Heuschrecke (15 min. im Kühlschrank oder auf Eis) mit der<br />
Ventralseite nach oben auf einer Wachsschale so festlegen, daß der Kopf den Rand der<br />
Schale überragt. Die Beine mit Plastilin (Knetmasse) befestigen <strong>und</strong> den Kopf so nach vorne<br />
ziehen, daß die ventral liegende dünne Kutikulamembran des Halses sichtbar wird <strong>und</strong><br />
etwas gestreckt ist. Die Halsmembran seitlich einritzen, so daß die beiden Halskonnektive,<br />
die zwischen zwei silbrig glänzenden Tracheen liegen, sichtbar werden (nicht mit der<br />
Pinzette quetschen!). Mit dem Mikromanipulator die zwei Hakenelektroden unter eines der<br />
beiden Konnektive fahren <strong>und</strong> vorsichtig anheben. Um Kurzschlüsse zu vermeiden <strong>und</strong><br />
dadurch gute extrazelluläre Ableitungen zu erzielen, muß die Hämolymphe zwischen den<br />
beiden Hakenelektroden <strong>und</strong> zwischen angehobenem Konnektiv <strong>und</strong> Tier mit einem Papiertuch<br />
abgetupft <strong>und</strong> der Ableitort mit Vaseline bedeckt werden.<br />
Aufgaben<br />
1. Damit Sie sich mit der Apparatur etwas vertraut machen können, notieren Sie, was<br />
passiert, wenn Sie:<br />
- die Zeit- <strong>und</strong> Vertikalablenkung im Spike II Programm (Bildschirm des PC)<br />
verändern<br />
- die beiden Filter (Highpass and lowpass) am Extrazellulärverstärker ändern<br />
- einen der beiden Stecker vom Elektrodenkabel aus dem Verstärker ziehen <strong>und</strong><br />
auf Masse legen<br />
- eine Hand in die Nähe des Präparates legen <strong>und</strong> mit der anderen zuerst das<br />
Lampengehäuse, danach die Erde am Analog-Digital-Wandler berühren<br />
2. Beschreiben Sie die Aktivität im Konnektiv, wenn Sie verschiedene Körperregionen<br />
mit einem Glasstab oder mit Windreizen aus einer Pasteurpipette mechanisch reizen,<br />
oder wenn Sie laute Schnalz- oder Klatschgeräusche machen, oder wenn Sie einen<br />
optischen Reiz benutzen. (Markieren Sie die Reize mit dem Eventmarker im Spike II<br />
Programm.)<br />
3. Weshalb sind die zu beobachtenden Aktionspotentiale verschieden groß?<br />
4. Lassen sich bestimmte Reize mit bestimmten Aktionspotentialen korrellieren (Besonders<br />
die größeren Aktionspotentiale beobachten)? Welches ist der zu ihrer Auslösung<br />
erforderliche spezifische Reiz?<br />
Beispiel: Berührungs- oder Windreiz, optischer, akustischer Reiz<br />
5. Handelt es sich um aufsteigende oder absteigende Neurone? Verlaufen die Axone<br />
ipsi- oder contralateral zum Reizort?<br />
35
6. Wenn Sie ein Neuron oder eine Gruppe von Neuronen aufgr<strong>und</strong> ihres Antwortverhaltens<br />
auf einen speziellen Reiz hin identifizieren konnten, untersuchen Sie<br />
genauer; z.B. wie verändert eine andere Reizintensität das Antwortverhalten. Wie<br />
könnten Sie die Größe des rezeptiven Feldes des untersuchten Neurons bestimmen?<br />
7. Halten Sie die Amplitude der Aktionspotentiale (in Volt) <strong>und</strong> ihre etwaige Frequenz (in<br />
Hertz) fest!<br />
8. Verändert sich die Antwort, wenn der Reiz mehrfach hintereinander in konstanten<br />
Zeitabständen verabreicht wird (z.B. alle 5 s)? Läßt sich damit eine Habituation<br />
(Gewöhnung) ggf. Dishabituation durchführen? Sie müssen sich vorher im klaren<br />
über die Versuchsdurchführung sein un dann jeden Reizdurchgang mit dem Eventmarker<br />
markieren.<br />
9. Wo könnte man die entsprechenden Aktionspotentiale noch ableiten? Warum tun wir<br />
es an diesen Stellen?<br />
Fragen<br />
Die Antworten auf diese Fragen sollten Sie im Protokoll in der Diskussion Ihrer Ergebnisse<br />
einbauen:<br />
- Wovon hängt die Größe extrazellulär abgeleiteter Aktionspotentiale ab?<br />
- Wie sieht die Form eines extrazellulär abgeleiteten Aktionspotentials im Vergleich zu<br />
einem intrazellulär abgeleiteten aus?<br />
- Durch welche Ionenströme wird die Form eines Aktionspotentials bestimmt?<br />
- Welche Funktion mag das untersuchte Neuron <strong>für</strong> das Verhalten des Tiers haben?<br />
- Was versteht man unter Habituation <strong>und</strong> Dishabituation?<br />
Zum Nachdenken<br />
Wozu werden Experimente in den Naturwissenschaften <strong>und</strong> insbesondere in der <strong>Neurobiologie</strong><br />
durchgeführt?<br />
Literatur:<br />
Rowell, C.H.F. (1971) The orthopteran descending movement detector (DMD) neurons: A<br />
characterisation and review. Z.verg.Physiol. 73:167-194<br />
Burrows, M. & Rowell, C.H.F. (1973) Connections between descending visual interneurons<br />
and metathoracic motoneurons in the locust. J.Comp.Physiol. A 85:221-234<br />
36
2. Versuchstag:<br />
Computersimulation von Nervensignalen<br />
Die genaue Messung von Spannungs- oder Stromsignalen an Nervenzellen erfordert<br />
meistens eine aufwendige Präparation <strong>und</strong> Apparatur. Die mathematische Beschreibung<br />
experimentell gewonnener Daten ermöglicht jedoch oftmals, ein Modell zu entwickeln, das<br />
die Eigenschaften des natürlichen Systems simuliert <strong>und</strong> Voraussagen über das elektrische<br />
Verhalten eines Neurons oder eines ganzen Netzwerks von Neuronen zulässt.<br />
An diesem Kurstag werden Sie mit einem Computerprogramm (Neurosim, Biosoft) arbeiten,<br />
das die Simulation der elektrischen Eigenschaften einer Nervenzelle erlaubt. Die zugr<strong>und</strong>e<br />
liegenden mathematischen Funktionen wurden bereits 1952 aus den bahnbrechenden<br />
Arbeiten von Hodgkin & Huxley abgeleitet. Ihre<br />
intrazellulären Ableitungen von Aktionspotentialen<br />
am Tintenfisch-Riesenaxon zeigten<br />
den weit ins Positive überschiessenden<br />
Spannungsverlauf (s. Abb.2.1). Durch<br />
Veränderungen der Ionenkonzentrationen (z.B.<br />
durch Ionensubstitution) zeigten sie, dass die<br />
zugr<strong>und</strong>e liegenden Ströme <strong>und</strong> Leitfähigkeitsänderungen<br />
der Membran ionenspezifisch sind. <br />
<br />
!"#!$%&'(<br />
Messungen mit der Voltage-Clamp Methode (Abb.2.2) erlaubten die kontrollierte Anwendung<br />
von Testspannungen zur genauen quantitativen Charakterisierung der Ionenströme sowie<br />
ihrer Zeitverläufe (Kinetik).<br />
Diese Methode zeigt z.B., dass eine plötzliche starke Depolarisierung der Membran einen<br />
schnellen Na + -Einwärtsstrom <strong>und</strong> einen langsamer aktivierenden K + -Auswärtsstrom auslöst.<br />
Die Ionen fliessen dabei rein passiv <strong>und</strong> unabhängig voneinander durch die Membran,<br />
angetrieben allein von einer ionenspezifischen Spannungsdifferenz, der elektromotorischen<br />
Kraft (EMK ion = V m - E ion ). Die EMK <strong>für</strong> eine Ionenart ergibt sich jeweils aus der Abweichung<br />
der tatsächlichen Membranspannung (V m ) vom entsprechenden (Nernst-) Gleichgewichtspotential<br />
(E ion ), das daher je nach Ionenverteilung allein die Richtung des Ionenstromes<br />
vorgibt.<br />
37
Abb. 2.2: Voltage-Clamp Methode: Die Membranspannung wird durch eine adäquate Strominjektion<br />
auf einer experimentell vorgegebenen Sollspannung gehalten (geklemmt). Die über Elektrode (E1)<br />
gegenüber dem geerdeten Außenmedium anliegende Membranspannung (Vm) wird am Differenzverstärker<br />
(A1) gemessen <strong>und</strong> mit einer vorgegebenen Sollspannung (V soll ) am VC-Verstärker (A2)<br />
verglichen. Abweichungen der Membranspannung von der Sollspannung führen zu einem Stromfluß<br />
(I) am Verstärkerausgang, der stark verstärkt über Elektrode (E2) als Ausgleichsstrom ins Zellinnere<br />
fließt bis das Membranpotential dem Sollwert (V m =V soll ) angeglichen ist. Ionenströme durch die<br />
Membran, die das Membranpotential z.B. während eines Aktionspotentials verändern würden, können<br />
so indirekt über die zur Aufrechterhaltung der Sollspannung nötige Strominjektion gemessen werden.<br />
Die Leitfähigkeit G der Membran, die bei gegebener EMK einen Stromfluss erlaubt, resultiert<br />
aus der Anzahl geöffneter Kanäle <strong>für</strong> die jeweilige Ionenart. Die maximale Leitfähigkeit G max<br />
ist entsprechend erreicht, wenn alle Kanäle geöffnet sind. Dabei ist die Offen-Wahrscheinlichkeit<br />
<strong>für</strong> einzelne Kanäle <strong>und</strong> damit die Gesamtleitfähigkeit sowohl spannungs- als auch<br />
zeitabhängig.<br />
Ein sigmoider Anstieg der Kaliumleitfähigkeit (g K ) im Verlaufe einer Membrandepolarisation<br />
führte zu der Vorstellung, dass im spannungsaktivierten K + -Kanal vier unabhängig voneinander<br />
öffnende Bereiche (n-Tore) vorliegen müssen. Für jedes einzelne dieser n-Tore steigt<br />
die Offenwahrscheinlichkeit mit zunehmender Membranspannung, jedoch müssen alle vier<br />
Tore gleichzeitig offen sein, um einen Ionenfluss durch den K + -Kanal zu ermöglichen. Die<br />
Offenwahrscheinlichkeit des K + -Kanals ermittelt sich entsprechend aus dem Produkt der vier<br />
Einzelwahrscheinlichkeiten der n-Tore (n 4 ). Für die K + -Leitfähigkeit <strong>und</strong> den K + -Strom bei<br />
gegebenem Testpotential (V m ) gilt dann:<br />
(1) g K = n 4 * g K(max) (2) I K = n 4 * g K(max) * (V m - E Na )<br />
Bei Spannunsänderung stellt sich <strong>für</strong> jedes n-Tor die neue Offenwahrscheinlichkeit zeitabhängig<br />
im Sinne einer einfachen Exponentialfunktion ein (n = 1 - e -t/(n) ). Die Zeitkonstante<br />
(n) verhält sich dabei ebenfalls spannungsabhängig. Je positiver die anliegende Spannung,<br />
desto schneller die Änderung ( (n) 1 ms bei Depolarisation auf 0 mV).<br />
Natriumströme fliessen bei konstanter Depolarisierung der Membran nur <strong>für</strong> kurze Zeit. Zu<br />
Beginn steigt die Leitfähigkeit ebenfalls sigmoid an (Aktivierung), wenn auch etwa 10x<br />
schneller als die <strong>für</strong> Kalium. Innerhalb von Millisek<strong>und</strong>en fällt die Leitfähigkeit jedoch wieder<br />
exponentiell ab (Inaktivierung). Dies beruht auf der Existenz von verschiedenartig auf eine<br />
Spannungsänderung reagierender Bereiche im Na + -Kanal (drei m- <strong>und</strong> ein h-Tor). Vergleichbar<br />
den n-Toren des K + -Kanals, erhöht eine Depolarisierung der Membran die Offenwahrscheinlichkeit<br />
der m-Tore. Umgekehrt reagiert jedoch das h-Tor, dessen Offenwahrscheinlichkeit<br />
durch Hyperpolarisierung erhöht wird.<br />
38
Leitfähigkeitsänderung <strong>und</strong> Natriumstrom folgen entsprechend dem Produkt aus der<br />
maximalen Leitfähigkeit, den drei aktivierenden, das m-Tor regelnden Prozessen <strong>und</strong> dem<br />
inaktivierenden, das h-Tor regelnden Prozess.<br />
(3) g Na = m 3 * h * g Na(max) (4) I Na = m 3 * h * g Na(max) * (V m - E Na )<br />
Der zeitlich exponentielle Anstieg der Offenwahrscheinlichkeit <strong>für</strong> das m-Tor (m = 1 - e -t/(m) )<br />
ist durch eine vergleichsweise viel kürzere Zeitkonstante ( (m) 0.1 ms bei 0 mV) charakterisiert<br />
als die des Inaktivierungsprozesses (h = e -t/(h) , mit (h) 1 ms). Dadurch ist gewährleistet,<br />
dass der Na + -Kanal bei Depolarisierung kurzfristig vollständig öffnen kann, wenn<br />
nämlich die m-Tore schneller öffnen als das h-Tor schliesst (Abb. 2.3).<br />
+ , <br />
<br />
1<br />
<br />
1<br />
. , <br />
<br />
1<br />
<br />
1<br />
)*""+ , -. , +<br />
+ , + - *"%""<br />
-/ (-<br />
!$ - / (0 <br />
-". , + <br />
" % 1<br />
*"0<br />
<br />
1<br />
Das Computerprogramm errechnet mit den gegebenen Funktionen <strong>für</strong> die Kalium- <strong>und</strong><br />
Natriumleitfähigkeit den Verlauf des Aktionspotentials. Ausgehend von einem überschwelligen<br />
Startpotential wird in kleinen Zeitschritten die jeweilige Leitfähigkeitsänderung,<br />
der dadurch ausgelöste Strom <strong>und</strong> die resultierende Membranspannung bestimmt.<br />
39
Durch Variationen der Parameter lässt sich das Programm mit seinen implementierten<br />
Funktionen nutzen, um deren Auswirkungen auf das Modellsystem zu testen <strong>und</strong> Erkenntnisse<br />
über das modellierte System zu bekommen. Änderungen der Ionenkonzentrationen,<br />
sprunghafte Änderungen der Membranspannung <strong>und</strong> artefizielle Strominjektionen sind nur<br />
einige Beispiele testbarer Modifikationen.<br />
Versuchsanleitung zum ersten Kurstag:<br />
Starten Sie in der Programmsammlung NEUROSIM (Biosoft) das Unterprogramm<br />
GOLDMAN<br />
Dieser Programmteil beschäftigt sich mit den Parametern Ionenkonzentration <strong>und</strong> –leitfähigkeit,<br />
welche das Ruhemembranpotential bestimmen.<br />
Laden Sie die Ionenverteilung <strong>für</strong> einen Tintenfisch (squid values)<br />
• Umstellung der Chloridverteilung ("switch Cl - distrib") auf "passiv"<br />
• Ändern Sie die K + -Konzentration des Außenmediums "K outside" (zwischen 800 <strong>und</strong> 0.1<br />
mM) <strong>und</strong> ermitteln Sie das resultierende Gleichgewichtspotential <strong>für</strong> K + (E k , Equilibrium<br />
potential) sowie das tatsächlich resultierende Membranpotential (V m = membrane potential).<br />
Tragen Sie beide in einer Grafik jeweils gegen die K + -Konzentration (x-Achse, logarithmisch)<br />
auf <strong>und</strong> erklären Sie die Abweichungen.<br />
• Stellen Sie <strong>für</strong> folgende Ionenverteilungen die jeweiligen Nernst´schen Gleichgewichtspotentiale<br />
bei 20°C auf <strong>und</strong> ermitteln Sie mit Hilfe der Goldmann-Gleichung das resultierende<br />
Membranpotential:<br />
Ion Permeabilität rel. Permeabilität Konz. intrazellulär Konz. extrazellulär<br />
(cm ⋅ s -1 ⋅ 10 -7 )<br />
K + 18 1,0 124 4<br />
Na + 0,7 0,04 50 470<br />
Cl - 7,9 0,4 55 580<br />
40
Programm HH.<br />
Dieser Programmteil simuliert die Generierung <strong>und</strong> die Verläufe von Aktionspotentialen.<br />
Ausgelöst werden die Aktionspotentiale durch eine direkte Strominjektion.<br />
Laden Sie die Parameter PARAM2 <strong>und</strong> starten Sie das Experiment (load parameters F10).<br />
• Verringern Sie erst die Stromamplitude des Stimulus ("set stimulus"), bis gerade kein<br />
Aktionspotential mehr auftritt. Erhöhen Sie schrittweise die Stimulationsintensität <strong>und</strong><br />
messen <strong>und</strong> notieren Sie die Dauer (in ms) bis zum Maximum des Aktionspotentials<br />
sowie den Spannungswert des Maximums (in mv). Im Grafikmodus über "measure" den<br />
Cursor (Kreuz) auf den gewünschten Punkt setzen <strong>und</strong> Werte ablesen. Stellen Sie die<br />
Ergebnisse grafisch dar <strong>und</strong> erklären Sie die Ergebnisse. Beantworten Sie dabei<br />
folgende Fragen: Wo liegt die Schwelle zur Auslösung eines Aktionspotentials, wodurch<br />
ist sie charakterisiert, was ist der Gr<strong>und</strong> <strong>für</strong> die Abnahme der maximalen Aktionspotentialamplitude<br />
<strong>und</strong> wie erklärt sich die verzögerte Auslösung eines Aktionspotentials<br />
bei schwachen Reizströmen?<br />
Laden Sie die Parameter IFCURVE <strong>und</strong> starten Sie das Experiment<br />
• Steigern Sie den Reizstrom (unter "stimulus, amplitude" Wert eingeben) bis ca. 100µA<br />
(10 Werte reichen meist, erst in kleinen dann in grossen Schritten) <strong>und</strong> bestimmen Sie<br />
die resultierende Entladungsfrequenz jeweils bei 6°C <strong>und</strong> 20°C. Tragen Sie diese als<br />
Grafik („I-F-Kurve“) zusammen gegen die jeweils verwendete Stimulusintensität auf.<br />
Welchen Einfluss hat die Temperatur auf die maximale Entladungsfreqzenz? Was<br />
beobachten Sie insbesondere bei stärkeren Strominjektionen hinsichtlich der ersten<br />
Aktionspotentialhöhen <strong>und</strong> des Entladungsverhaltens über die gesamte Stimulusdauer?<br />
Woran kann das liegen? Versuchen sie durch Erhöhung der internen K + -Konzentration<br />
sowie durch Anwendung von Giften (TTX, TEA) ein Verständnis zu entwickeln.<br />
Aktivierung:<br />
Laden Sie die Parameter PARAM4 <strong>und</strong> wechseln Sie in den Voltage-Clamp-Modus (toggle<br />
clamp)<br />
• Setzen Sie die Haltespannung auf –70mV ("holding pot") <strong>und</strong> die Klemmspannung auf<br />
+30mV ("clamp pot"). Starten Sie den Spannungssprung durch „Experiment“ <strong>und</strong> lassen<br />
Sie sich dabei vorerst den ausgelösten Gesamtstrom zeigen. Wie verläuft der Stromfluss<br />
in Abhängigkeit von der Zeit?<br />
• Stellen Sie sich den K + -Strom bzw. den Na + -Strom unter Anwendung selektiver Kanalblocker<br />
("apply drugs", TTX bzw. TEA anwählen) isoliert dar. Beschreiben Sie kurz den<br />
zeitlichen Verlauf.<br />
41
• Testen Sie ausgehend vom Haltepotential (–100mV) verschiedene Klemmspannungen<br />
(von -100 bis +50 mV in 10mV Schritten) <strong>und</strong> bestimmen Sie jeweils den maximalen<br />
Stromfluss von Kalium bzw. Natrium-Ionen. Beachten Sie dabei, dass die Maxima zu<br />
unterschiedlichen Zeiten erreicht werden. Tragen Sie (zuhause) die gemessenen<br />
maximalen Stromstärken, I Na <strong>und</strong> I K , in Abhängigkeit von der Klemmspannung als I-V-<br />
Kurve auf <strong>und</strong> vergleichen <strong>und</strong> diskutieren Sie kurz die Verläufe. Wo liegt jeweils das<br />
Umkehrpotential <strong>für</strong> jeden Strom?<br />
• Errechnen Sie mit Hilfe der Beziehung: g = I / EMK (da<strong>für</strong> müssen die Ionenkonzentrationen<br />
notiert werden) aus den Strommaxima die Leitfähigkeiten gK + <strong>und</strong> gNa + <strong>und</strong> tragen<br />
Sie diese in Abhängigkeit von der Klemmspannung auf. Beschreiben <strong>und</strong> erklären Sie<br />
kurz den Verlauf.<br />
Inaktivierung:<br />
Die Gleichgewichtsinaktivierung von Na + -Kanälen bei verschiedenen Spannungen lässt sich<br />
durch Veränderung der Haltespannung, von der aus ein Sprung auf eine immer gleiche<br />
Klemmspannung (–10mV) folgt, bestimmen.<br />
• Variieren Sie unter TEA (s.o.) die Haltespannung ausgehend von -100mV bis -10mV in<br />
10mV-Schritten <strong>und</strong> bestimmen Sie das Maximum des jeweils anschliessend durch einen<br />
Spannungssprung auf die Klemmspannung -10mV ausgelösten Na + -Stroms. Tragen Sie<br />
diesen Na + -Strom jeweils in Relation zum grösstmöglichsten Strom (I/I max ) über der<br />
Haltespannung grafisch auf <strong>und</strong> diskutieren Sie kurz den Verlauf.<br />
Mit Hilfe des Programms CABLE soll ein Versuch simuliert werden, bei dem am Ort der<br />
Strominjektion <strong>und</strong> in verschiedenen Abständen von der Reizelektrode die Spannungsantwort<br />
der Membran bzw. entlang einer Nervenfaser/Dendriten gemessen wird.<br />
Spannungsabhängige Ionenkanäle sollen hier keine Rolle spielen, d.h. es wird ausschließlich<br />
passive Erregungsleitung simuliert.<br />
Starten Sie das Programm CABLE <strong>und</strong> laden Sie die Parameter TC-IR-1.<br />
Notieren Sie sich die gegebenen Parameter <strong>für</strong> die elektrischen Eigenschaften der Nervenfaser<br />
sowie die experimentellen Umstände (Reizstromstärke) <strong>und</strong> starten Sie das Experiment.<br />
• Beschreiben Sie den zeitlichen Verlauf der Spannungsantwort.<br />
• Ermitteln Sie den Eingangswiderstand des Neurons (Ohmsches Gesetz: Spannungsantwort<br />
/ Reizstrom = Membranwiderstand). Ändert sich dieser bei höheren Reizströmen?<br />
42
• Ermitteln Sie die Zeitkonstante durch Ausmessen der Zeit, die die Spannung benötigt,<br />
63% des Maximalwerts zu erreichen. Ändert sich der Wert bei höheren Reizströmen?<br />
Einstellen des Abstands des Messelektrode auf 2,2 mm.<br />
• Verdoppeln Sie jetzt die Membrankapazität (C m ). Wie ändern sich die maximal erreichte<br />
Spannung <strong>und</strong> τ ? Was passiert, wenn Sie den Membranwiderstand um die Hälfte<br />
verringern?<br />
Laden Sie die Parameter LAMBDA.<br />
Hier sind drei Elektroden in variablem Abstand von der Reizelektrode gesetzt. Starten Sie<br />
das Experiment.<br />
• Messen sie die Spannungswerte in verschiedenen Abständen (1, 2, 3, 4, 5 mm). Tragen<br />
Sie den Spannungsabfall über die Distanz graphisch auf <strong>und</strong> ermitteln Sie daraus die<br />
Längskonstante. Vergleichen Sie diesen Wert mit dem des Programms.<br />
• Nun erhöhen Sie den Membranwiderstand (R m = 20 k ⋅ cm 2 ) <strong>und</strong> ermitteln wieder die<br />
Spannungsantworten in Abhängigkeit von der Distanz zur Reizelektrode. Wie verändert<br />
sich hierbei Lambda? Wie interpretieren Sie die Kurven hinsichtlich der elektrotonischen<br />
Ausbreitung von Erregung in einer Nervenzelle?<br />
43
3. Versuchstag:<br />
Auslösung <strong>und</strong> Erregungsleitung von Aktionspotentialen im Bauchmark des Regenwurms,<br />
Lumbricus terrestris<br />
Einführung<br />
Mittels von Aktionspotentialen wird im Nervensystem Information über weite Strecken fortgeleitet.<br />
Die Fortleitungsgeschwindigkeit von Aktionspotentialen bestimmen die Reaktionsgeschwindigkeit<br />
von Reflexen <strong>und</strong> die Frequenz, mit der Aktionspotentiale generiert werden<br />
können, bestimmen die Reaktionsstärke von Reflexen.<br />
Insbesondere bei Meide- <strong>und</strong> Fluchtreflexen ist eine schnelle Erregungsleitung wichtig. Im<br />
Laufe der Evolution wurde dies auf folgende Weisen erreicht:<br />
- die Vergrößerung des Axondurchmessers<br />
- die Myelinisierung von Axonen (primär bei Wirbeltieren, saltatorische Erregungsleitung)<br />
- elektrische Synapsen<br />
- geringe Anzahl von Synapsen in der Reflexbahn<br />
Axone mit besonders großen Durchmessern sind bei vielen Invertebraten vorhanden. So<br />
wird das Bauchmark von Oligochaeten <strong>und</strong> das von vielen Polychaeten in seiner gesamten<br />
Länge von Riesenfasern durchzogen. Fast alle Oligochaeten haben drei dorsal im Bauchmark<br />
gelegene Riesenfasern, welche Interneurone sind (Abb. 1). Beim Regenwurm beträgt<br />
der Durchmesser der medianen Riesenfasern (MRF) ca. 75 µm Durchmesser, <strong>und</strong> der der<br />
beiden lateralen Riesenfasern (LRF) jeweils 50 µm. Der Durchmesser der MRF wird nach<br />
posterior <strong>und</strong> die Durchmesser der beiden LRF werden nach anterior kleiner. Sowohl die<br />
MRF als auch die LRF sind von einer auffällig dicken Gliahülle mit vielschichtigen Myelinlamellen<br />
(Markscheide) umgeben, eine Gegebenheit, die als Regelfall nur bei Wirbeltieren<br />
auftritt. Eine solch dicke Gliahülle ist bei Invertebraten neben dem Regenwurm nur bei<br />
Krebsen nachgewiesen. Die Gliahülle der MRF ist dicker als die der LRF. Bei der MRF von<br />
L. terrestris wurde eine saltatorische Erregungsleitung gezeigt. Intersegmental grenzen die<br />
Neurone in eng aneinanderliegenden Membranabschnitten (6,5 - 7,5nm), den sogenannten<br />
Septen, aneinander. Diese Membranabschnitte sind zum Teil durch „gap junctions", miteinander<br />
verb<strong>und</strong>en (elektrische Synapsen), zum Teil sind die Septen aufgelöst, so dass eine<br />
durchgehende protoplasmatische Verbindungen zwischen den Zellen besteht (beim adulten<br />
Regenwurm sind etwa 60% der Septen der MRF <strong>und</strong> 20% der Septen der LRF<br />
44
Abb. 1: Lumbricus terrestris. (A) Transversalschnitt, welcher die Lage der Riesenfasern <strong>und</strong> der<br />
longitudinalen Haupttrakte des Bauchmarks zeigt. (B) Rekonstruktion des Bauchmarks, welche die<br />
Lage der MRF, der LRF, der Rieseninterneuron, der sensorischen Trakten <strong>und</strong> der Motorneurone<br />
zeigt.<br />
45
aufgelöst). Durch den Wegfall von Synapsen wird die Fortleitungsgeschwindigkeit der<br />
Aktionspotentiale erhöht. Dieses bedeutet auch, dass die Riesenfasern nicht nur aus dem<br />
Axon eines Neurons bestehen, sondern aus miteinander verschmolzenen Nervenzellen<br />
(Syncytium, pro Segment 1 Zellkörper). Die LRF sind durch elektrische Synapsen miteinander<br />
verb<strong>und</strong>en, die sich in segmentalen Querbrücken (Anastomosen, Abb. 1) befinden.<br />
Dadurch werden die Aktionspotentiale beider LRF über die gesamte Länge des Wurmens<br />
synchronisiert <strong>und</strong> das extrazellulär abgeleitete Potential ist die Summe der Aktionspotentiale<br />
beider LRF. Neben der MRF <strong>und</strong> den LRF sind in jedem Segment jeweils ein Paar<br />
lateraler <strong>und</strong> ein Paar ventraler Rieseninterneurone sowie Riesenmotorneurone lokalisiert.<br />
Während die Erregungsmuster zur Steuerung der meisten Bewegungen beim Regenwurm in<br />
polysynaptischen Netzwerken mit relativ langsam leitende Neuronen generiert werden, sind<br />
die Riesenfasern an schnellen <strong>und</strong> koordinierten Meidereaktionen beteiligt. Die MRF <strong>und</strong> die<br />
LRFs sind unterschiedlich mit sensorischen <strong>und</strong> motorischen Neuronen verschaltet. Die<br />
MRF wird von Rieseninterneuronen erregt, die ihrerseits durch Sinneszellen (z. B. Mechanorezeptoren)<br />
aus den vorderen Körpersegmenten erregt werden. Die LRF erhalten dagegen<br />
wahrscheinlich direkte Eingänge von Sinneszellen der posterioren Körpersegmente. Sowohl<br />
die Aktivität der MRF als auch die der LRF wird auf Motorneurone verschaltet, die ihrerseits<br />
die Längsmuskulatur innervieren. Die LFR verschalten allerdings zusätzlich auf Motorneurone,<br />
die die Muskulatur zum Ausstrecken von Borsten am anterioren Körperende innerviert,<br />
wohingegen die MFR auf Motorneurone verschaltet, deren Aktivität zum Ausstrecken<br />
der Borsten am posterioren Körperende führt. Daher führt Aktivität der LFR letztendlich<br />
dazu, dass das anteriore Körperende am Substrat festgehalten <strong>und</strong> das posteriore<br />
Körperende weggezogen wird. Die Aktivität der MFR dagegen führt zur Abflachung des<br />
posterioren Körperendes, wodurch das anteriore Körperende weggezogen wird. Die Aktionspotentialfrequenz<br />
in den jeweiligen Sinneszellen kodiert die Reizstärke <strong>und</strong> bestimmt die<br />
Anzahl der Aktionspotentiale in den Riesenfasern, <strong>und</strong> somit auch die Stärke der<br />
Rückzugsantwort (Meidereaktion).<br />
Experimentelle Aufgaben<br />
Zunächst sollen einige Verhaltensbeobachtungen zur Lokomotion am intakten Wurm durchgeführt<br />
werden. Dann soll die neuronale Aktivität der RF sowohl bei mechanischer als auch<br />
bei elektrischer Reizung abgeleitet werden. Wie bereits festgestellt, legt u.a. die Fortleitungsgeschwindigkeit<br />
fest, wie schnell Information in polysynaptischen Schaltkreis<br />
weitergeleitet wird. Je größer die Spanne zwischen der niedrigsten <strong>und</strong> der höchsten<br />
Frequenz ist, mit der Axone Aktionspotentiale generieren können, desto mehr Information<br />
46
kann auf die postsynaptische Zelle übertragen werden. Sowohl die Fortleitungsgeschwindigkeit<br />
als auch die maximale Aktionspotential-Frequenz der beiden<br />
Riesenfasersysteme soll daher bestimmt werden.<br />
Aufgaben<br />
1. Kurze Beobachtung der Lokomotion des intakten Wurms<br />
Der Wurm wird auf ein angefeuchtetes Filterpapier gelegt <strong>und</strong> während der Kriechbewegung<br />
beobachtet. Meidereaktionen werden durch Berühren des anterioren- bzw. des posterioren<br />
Körperendes des Wurms mit einem stumpfen Gegenstand ausgelöst.<br />
Beobachten Sie die peristaltischen Wellen während der Kriechbewegung, <strong>und</strong> vergleichen<br />
Sie die aufeinander abgestimmte Bewegung der Körpersegmente mit der Koordination der<br />
Segmente während der Meidereaktionen.<br />
Worin besteht der Unterschied in den Meidereaktionen, wenn sie während der Bewegung<br />
oder wenn sich der Wurm in Ruhe befindet, ausgelöst werden?<br />
Welche Aufgabe erfüllen die ventral <strong>und</strong> lateral aus dem Hautmuskelschlauch austretenden<br />
Borsten bei der Lokomotion?<br />
2. Registrierung der Riesenfaser-Antworten bei mechanischer <strong>und</strong> elektrischer Reizung<br />
Präparation<br />
Um den Wurm <strong>für</strong> die Präparation leicht zu "betäuben", wird er kurz in ein Becherglas<br />
gelegt, das etwa zwei Finger hoch mit Eiswasser gefüllt ist. Ist er bewegungsunfähig, wird er<br />
mit der Ventralseite nach unten vorn <strong>und</strong> hinten in die Halterungen der Ableitwanne eingeklemmt.<br />
Dabei ist darauf zu achten, dass er an beiden Enden über den paarigen Reizelektroden<br />
liegt. Der freiliegende mittlere Teil des Wurms wird nun mit Nadeln fixiert, die<br />
neben den Halterungen seitlich in den Hautmuskelschlauch (HMS) eingestochen werden.<br />
Während der weiteren Präparation wird der Mittelteil des Wurms gelegentlich mit gekühlter<br />
Ringerlösung gespült.<br />
Mit einem flach geführten Schnitt (mit der Präparierschere) entlang der dorsalen Medianlinie<br />
wird nun der HMS 2-3 cm geöffnet, wobei der Darm des Tieres sichtbar wird. (Vorsicht,<br />
Darm nicht verletzen. Austretende Verdauungssäfte schädigen das Bauchmark, so dass<br />
eine neue Präparation nötig wird).<br />
47
Der HMS wird mit Nadeln auseinandergeklappt <strong>und</strong> in der Wachsplatte der Ableitwanne<br />
fixiert, so dass der Darm vorsichtig auf eine Seite gelegt werden kann. Dabei muss er mit<br />
einem Glasstab von Dissepimenten befreit werden, die ihn mit dem HMS verbinden.<br />
Das Bauchmark (Abb. 2), das als weißlicher Strang sichtbar ist, wird ebenfalls mit einem<br />
Glasstab von den Resten der Dissepimente <strong>und</strong> den segmentalen Nerven getrennt, so dass<br />
es sich auf einer ca. 2 cm langen Strecke vom HMS abheben lässt.<br />
Die Ableitelektroden werden unter das Bauchmark gelegt <strong>und</strong> leicht angehoben. Die W<strong>und</strong>e<br />
wird mit Ringerlösung angefeuchtet. Während des Versuchs darf das Bauchmark an der<br />
Ableitstelle nicht mit Ringerlösung in Kontakt stehen (am besten wird die Lösung an dieser<br />
Stelle mit einem kleinen Papiertuch vorsichtig abgesaugt), denn sonst kommt es zu einem<br />
Kurzschluss.<br />
Alternative Möglichkeit falls keine stabilen Ableitungen vom Bauchmark erzielt werden<br />
sollten: Aufgr<strong>und</strong> der extrem dicken Durchmesser der Riesenfasern ist es möglich, deren<br />
elektrische Feldpotentiale auch durch den geschlossenen Hautmuskelschlauch hindurch<br />
abzuleiten. In diesem Fall wird der intakte Regenwurm mit der Ventralseite nach unten in die<br />
Halterungen der Ableitwanne eingeklemmt. Dabei ist darauf zu achten, dass er an beiden<br />
Enden über den paarigen Reizelektroden liegt. Dieses experimentelle Design hat folgende<br />
Nachteile: Die abgeleiteten Feldpotentiale sind aufgr<strong>und</strong> der größeren Entfernung zu den<br />
Elektroden kleiner <strong>und</strong> somit schwieriger zu identifizieren. Zweitens verändert jede<br />
Bewegung des Tieres die Form der Feldpotentiale, da die Elektroden nicht direkt an den<br />
Riesenfasern anliegen. Drittens werden die Potentiale der Riesenfasern von den aus dem<br />
Hautmuskelschlauch abgeleiteten Muskelpotentialen maskiert. Viertens kann die Reizschwelle<br />
zum Auslösen von Muskelkontraktionen durchaus unter der zum Auslösen von<br />
Aktionspotentialen in den Riesenfasern liegen, was alle Experimente mit elektrischer<br />
Reizung erheblich erschwert. Der Vorteil dieses Ansatzes besteht darin, dass man auch die<br />
aus dem Meidereflex resultierenden Muskelpotentiale ableitet.<br />
48
Abb. 2: Anatomie von Lumbricus terrestris (nach Renner).<br />
49
a. Mechanische Reizung<br />
Das Vorder- <strong>und</strong> Hinterende des Wurmes wird mit einem Holzstab durch die Löcher in den<br />
Halterungen mechanisch gereizt, <strong>und</strong> die elektrische Aktivität des Bauchmarks wird abgeleitet.<br />
3. Unterscheiden Sie die Amplitude <strong>und</strong> die Form der Impulse, wenn das anteriore bzw.<br />
das posteriore Körperende gereizt wird, <strong>und</strong> ordnen Sie die Impulse den verschiedenen<br />
Riesenfasern zu.<br />
4. Lassen sich Bewegungen des Wurms auf die Reize hin beobachten, <strong>und</strong> wie sind diese<br />
mit den Aktivitäten des Bauchmarkes korreliert?<br />
b. Elektrische Reizung<br />
Um genauere Unterschiede zwischen den beiden Riesenfasersystemen experimentell zu<br />
untersuchen, ist es notwendig, die Aktionspotentiale in den Riesenfasern kontrolliert zu<br />
erzeugen. Dies ist durch elektrische Reizung möglich.<br />
5. Messung der Reizschwelle <strong>und</strong> Identifizierung der Aktionspotentiale<br />
Protokollieren Sie die Reizstärke, bei der sich zum erstenmal Impulse ableiten lassen. Bei<br />
weiterer Erhöhung der Reizstärke wird ein zweites Aktionspotential auftreten (warum?).<br />
Messen Sie den zeitlichen Abstand zwischen den Ereignissen, ordnen Sie die Ereignisse<br />
Ihrem Versuchsaufbau zu <strong>und</strong> begründen Sie die Zuordnung (Verzögerung, Latenz, Aktionspotentiale<br />
der Riesenfasertypen, Stimulusartefakt).<br />
Vergleichen Sie Form <strong>und</strong> Amplitude der Aktionspotentiale, wenn Sie am Vorder- <strong>und</strong> am<br />
Hinterende des Wurmes reizen. Welche Unterschiede gibt es zur mechanischen Reizung?<br />
Ordnen Sie die Impulse den beiden Riesenfasersystemen zu, <strong>und</strong> begründen Sie Ihre<br />
Zuordnung. Warum werden die Riesenfasern bei geringer elektrischer Reizspannung zuerst<br />
erregt, <strong>und</strong> warum leiten Sie nur 2 verschiedene Aktionspotentiale ab? Welche Aktionspotentialamplitude<br />
kann welcher Riesenfaser zugeordnet werden.<br />
50
6. Abschätzen der Fortleitungsgeschwindigkeit<br />
Aus der Latenz zwischen Stimulusartefakt <strong>und</strong> Aktionspotentialen <strong>und</strong> dem Abstand<br />
zwischen Reiz- <strong>und</strong> Ableitelektroden lassen sich die Fortleitungsgeschwindigkeiten der<br />
Aktionspotentiale <strong>für</strong> die beiden Riesenfasersysteme abschätzen.<br />
Geben sie die Fortleitungsgeschwindigkeiten in m/sec an. Um die Fortleitungsgeschwindigkeit<br />
zu bestimmen, messen Sie die Latenz zwischen Reizartefakt <strong>und</strong> Aktionspotential <strong>und</strong><br />
den Abstand zwischen Reiz- <strong>und</strong> Ableitelektroden. Da die Fortleitungsgeschwindigkeit<br />
temperaturabhängig ist, sollten Sie darauf achten, dass Sie die Temperatur während der<br />
Messungen ungefähr konstant halten. Diskutieren Sie warum die MRF eine höhere Fortleitungsgeschwindigkeit<br />
hat als die LRF. Erklären Sie auch warum die Fortleitungsgeschwindigkeit<br />
davon abhängt ob die vorderen oder hinteren Elektroden <strong>für</strong> die elektrische<br />
Reizung verwendet werden. Diskutieren Sie die Funktion der elektrischen Synapsen der<br />
MRF <strong>und</strong> der LRF.<br />
7. Messen der maximalen AP-Frequenzen <strong>und</strong> der Refraktärphasen<br />
Die einfachste Möglichkeit, die maximale Frequenz zu messen, mit der noch Aktionspotentiale<br />
ausgelöst werden können, ist es, mit zwei Pulsen zu reizen, die kurz aufeinander<br />
mit variabler Verzögerung folgen. Dazu stellen Sie den linken Schiebeschalter des Reizgenerators<br />
auf „Twin-Puls". Mit dem „Delay"-Knopf wird nun der zeitliche Abstand zwischen<br />
zwei Reizpulsen reguliert, Stellen Sie die Reizstärke auf einen Wert ein, der gerade oberhalb<br />
der Schwellenreizstärke zur Auslösung eines Aktionspotentiales liegt (Pulsdauer 0,1 ms),<br />
<strong>und</strong> applizieren Sie „Twin“ Pulse <strong>und</strong> nehmen Sie ein elektronisches Datenfile mit Hilfe des<br />
CEDs auf. Beginnen Sie mit einem möglichst großen zeitlichen Abstand zwischen den<br />
beiden Reizpulsen eines „Twin“ Pulses.<br />
Im Folgenden verringern Sie den zeitlichen Abstand zwischen den Reizpulsen, bis der zweite<br />
Puls gerade kein Aktionspotential mehr auslöst. Protokollieren Sie die Aktionspotentialamplituden<br />
zu den verschiedenen zeitlichen Abständen. Erhöhen Sie dann die Reizamplitude<br />
soweit, bis gerade wieder ein Aktionspotential sichtbar wird. Fahren Sie auf diese<br />
Weise fort, bis eine Reizamplitude von maximal 10 V erreicht wird. Protokollieren Sie die<br />
Reizstärken <strong>und</strong> den zeitlichen Abstand zwischen den Pulsen. Bei diesem Experiment ist es<br />
natürlich günstig, wenn nur noch eines der Riesenfasersysteme funktioniert. Ist das nicht der<br />
Fall müssen Sie die einzelnen Aktionspotentialtypen anhand ihrer Form identifizieren.<br />
51
Tragen Sie zum einen die Amplitude des zweiten Aktionspotentials bei der zuerst gewählten<br />
Schwellenreizstärke gegen den zeitlichen Abstand zwischen den Reizpulsen graphisch auf.<br />
Zum andern stellen Sie die Schwellenreizstärken als Funktion der Verzögerung zwischen<br />
den Reizpulsen dar. Diskutieren Sie anhand Ihrer Daten die Begriffe „absolute" <strong>und</strong> „relative<br />
Refraktärphase". Mit welcher Maximalfrequenz können die Riesenfasern feuern?<br />
Fragen <strong>und</strong> Probleme, die Sie im Rahmen Ihres Protokolls behandeln sollten:<br />
- Wie werden Aktionspotentiale weitergeleitet? Welche Eigenschaften von Nervenzellen<br />
bestimmen die Fortleitungsgeschwindigkeit von Aktionspotentialen? Nach<br />
welchen Prinzipien lässt sich die Fortleitungsgeschwindigkeit erhöhen? Warum?<br />
- Aus welchem Gr<strong>und</strong> ist die Erregungsübertragung an elektrischen Synapsen<br />
schneller als an chemischen Synapsen?<br />
- Bringen Sie das beobachtete Verhalten des Regenwurms mit Ihren Kenntnissen über<br />
die Riesenfasersysteme in Zusammenhang. Worin unterscheidet sich die Kriechbewegung<br />
des Regenwurms von den schnellen Meidereaktionen?<br />
- Was verstehen Sie unter Refraktärphase? Erklären Sie, wie die maximale Aktionspotentialfrequenz<br />
von Axonen mit den Leitfähigkeitsänderungen <strong>für</strong> Na + - <strong>und</strong> K + -<br />
Ionen zusammenhängt.<br />
Literatur<br />
P.J. Mill, Recent Developments in Earthworm Neurobiology. Comp. Biochem. Physiol. 73 A,<br />
641-661, 1982.<br />
52
4. Versuchstag:<br />
Funktionsweise eines Mechanorezeptors:<br />
Der Flügelstreckrezeptor der Wanderheuschrecke<br />
Sinnesorgane haben die Funktion, Ereignisse der inneren oder äußeren Umwelt eines<br />
Tieres durch geeignete Hilfsstrukturen zu registrieren <strong>und</strong> in bioelektrische Erregungen ihrer<br />
Sinneszellen umzuwandeln (Transduktion). Dabei besteht ein Zusammenhang zwischen der<br />
Stärke des Reizes <strong>und</strong> der "Stärke" der Erregung (erst als Rezeptorpotential <strong>und</strong> dann als<br />
Aktionspotentialfrequenz), der in einer Kennlinie dargestellt werden kann (Ordinate:<br />
Rezeptorpotential in mV oder Frequenz der Aktionspotentiale in Hz, Abszisse: Reizintensität,<br />
oft logarithmisch aufgetragen). Die Erregungen der Sinneszellen werden meist in Form von<br />
Aktionspotentialen in das ZNS geleitet <strong>und</strong> dort weiter verarbeitet (Integration). In diesem<br />
Versuch soll ein Mechanorezeptor, der Flügel-Streckrezeptor einer Heuschrecke, untersucht<br />
werden. Hierzu werden Aktionspotentiale extrazellulär von einem peripheren Nerv abgeleitet,<br />
in dem das Streckrezeptoraxon verläuft, <strong>und</strong> die Erregung des Streckrezeptors in Abhängigkeit<br />
von stufenförmigen Auf- <strong>und</strong> Abwärtsbewegungen eines Flügels registriert. Auf diese<br />
Weise können die Kennlinien <strong>und</strong> das Adaptationsverhalten der Rezeptoranwort untersucht<br />
werden.<br />
Theoretische Gr<strong>und</strong>lagen<br />
Der Flügelstreckrezeptor besteht aus einer einzigen Rezeptorzelle in enger Verbindung mit<br />
einem straffen Bindegewebsstrang, der zwischen zwei Kutikulaplatten im membranösen<br />
Gelenk jedes der vier Flügel aufgespannt ist. Durch Anheben eines Flügels oder Kippen<br />
seiner Vorderkante nach unten (Pronation) wird der Strang gestreckt. Dies führt zur Öffnung<br />
von mechanosensitiven Ionenkanälen in den Dendriten, damit zur Depolarisation der<br />
Rezeptorzellmembran <strong>und</strong> zur Auslösung von Aktionspotentialen im Axon der Zelle. Zwar<br />
enthält der Nerv, in dem das Streckrezeptoraxon verläuft (N1D 2 ), viele andere Axone, diese<br />
haben aber einen wesentlich geringeren Durchmesser, sodaß Aktionspotentiale des Streckrezeptors<br />
in extrazellullären Summenableitungen deutlich hervortreten. Somit kann ohne<br />
Schwierigkeiten die Aktivität einer einzelnen sensorischen Rezeptorzelle mit einfachen<br />
Mitteln (extrazelluläre, bipolare differentielle Ableitung) studiert werden!<br />
53
A: Halbschematische Zeichnung der Lage der Ganglien <strong>und</strong> des Verlaufs des Vorderflügelnervs<br />
(N1) einer längseröffneten Wanderheuschrecke.<br />
B: Schema der Sinnesorgane des Heuschreckenvorderflügels <strong>und</strong> ihre Innervierung<br />
durch den Flügelnerv (N1)<br />
54
Der Streckrezeptor gehört zu dem weit verbreiteten Typ der phasisch-tonischen Sinneszellen.<br />
Bei geschlossenem Flügel kann eine relativ gleichmässige (tonische) Entladung des<br />
Streckrezeptors von ca. 5-20 Impulsen/sec (Hz) abgeleitet werden. Anheben des Flügels<br />
führt zu einer raschen Erhöhung der Entladungsrate (phasischer Anteil der Antwort). Danach<br />
sinkt durch Adaptation allmählich die Entladungsfrequenz auf einen <strong>für</strong> diese Stellung neuen<br />
Ruhewert ab (tonischer Anteil der Antwort).<br />
Mittels der intrazellulären Ableittechnik wurde gezeigt, daß zwischen Steckrezeptor (SR) <strong>und</strong><br />
Motoneuronen (MN), die die Flügelsenkermuskeln innervieren, eine monosynaptische<br />
Verbindung besteht: Auf jedes Streckrezeptoraktionspotential folgt nach einer konstanten<br />
Latenz von ca. 1 ms (gemessen nach Abzug der Leitungszeit der Streckrezeptoraktionspotentiale<br />
vom Ableitort bis zum ZNS) ein exzitatorisches postsynaptisches Potential (EPSP)<br />
im Motoneuron.<br />
Dem gegenüber rufen Streckrezeptoraktionspotentiale in Motoneuronen, die Flügelhebermuskeln<br />
versorgen, inhibitorische post-synaptische Potentiale (IPSP's) hervor. Allerdings ist<br />
diese Verschaltung höchstwahrscheinlich polysynaptisch (d.h. es ist mindestens ein<br />
hemmend wirkendes Interneuron (IN) zwischen Streckrezeptor <strong>und</strong> Motoneuron geschaltet).<br />
55
Die Funktion der Streckrezeptoren beim Flug der Heuschrecke ist vermutlich die Festlegung<br />
des oberen Wendepunkts (Umschlagpunkt) eines Flügels. Zuerst glaubte man, sie seien Teil<br />
eines Reflexkreises, der <strong>für</strong> die Erhaltung der rhythmischen Flugbewegungen verantwortlich<br />
ist. Durchtrennungen der 4 Streckrezeptoraxone zeigten jedoch, daß Flügelschläge weiterhin<br />
durchgeführt werden können, allerdings mit verminderter Frequenz. Heute herrscht die<br />
Meinung vor, daß das ZNS sogar im isoliertem Zustand durch die Aktivität eines neuronalen<br />
Netzwerks (zentraler Muster-Generator) ein flugähnliches motorisches Muster erzeugen<br />
kann. Im intakten Tier werden die endgültigen präzisen Flügelbewegungen durch<br />
sensorische Eingänge (z.B. vom Streckrezeptor, sensorische Rückkopplung), die auf das<br />
zentral erzeugte Muster einwirken, angepasst <strong>und</strong> verändert (moduliert). Der Streckrezeptor<br />
könnte als Regler <strong>für</strong> die Schlagfrequenz, die Schlagamplitude <strong>und</strong> den Anstellwinkel des<br />
Flügels dienen <strong>und</strong> ist nur während eines bestimmten Zeitfensters eines Flügelschlags aktiviert<br />
<strong>und</strong> damit wirksam (phasenabhängiger Reflex, bedeutet, daß die sensorische Rückkopplung<br />
nur innerhalb einer bestimmten Bewegungsperiode wirksam ist).<br />
Extrazelluläre Ableitungen vom Streckrezeptornerv während des (fixierten) Fluges einer<br />
Wanderheuschrecke zeigen, daß der Sterckrezeptor bei jedem Flügelschlag jeweils am<br />
oberen Wendepunkt des Flügels 1 bis 2 Aktionspotentiale erzeugt.<br />
Ausführung<br />
Aktionspotentiale des Streckrezeptoraxons des Vorderflügels werden vom Nerv (N1D)<br />
mittels bipolarer Hakenelektroden <strong>und</strong> einem differentiellen AC-Verstärker extrazellulär<br />
abgeleitet. Bevor Sie anfangen, sollten Sie dieses Skript genau durchlesen!<br />
Präparation<br />
- Heuschrecke durch Kühlung betäuben (15 min in Kühlschrank oder auf Eiswasser).<br />
- Kopf <strong>und</strong> Pronotum mit einer Schere abtrennen.<br />
- Die Beine an der Coxa, <strong>und</strong> das Abdomen zwischen dem 2. <strong>und</strong> 3. Abdominalsegment<br />
abschneiden.<br />
- Darm aus dem Thorax mit einer Pinzette herausziehen.<br />
- Nach Aufklappen der Flügel wird der dorsale Deckel des Thoraxes mit einem<br />
medialen Längsschnitt durchtrennt.<br />
- Nach leichtem Öffnen des Thorax wird das Präparat auf einer mit Wachs gefüllten<br />
Wanne mit Nadeln befestigt. Die Nadeln dürfen nicht durch das Flügelgelenk<br />
gesteckt werden oder die Bewegungen des Flügels beeinträchtigen! Auslenkungen<br />
des Flügels sollten nicht allzu große Bewegungen des restlichen Präparates<br />
bewirken.<br />
56
- Vorderflügel im Halter der Reizapparatur mit Klebeband befestigen. Der Flügeldrehpunkt<br />
muss mit dem Drehpunkt des Reizapparates übereinstimmen.<br />
- Hakenelektroden leicht auf den Luftsack auflegen, an der Stelle, an der unterhalb<br />
des Luftsacks der Nerv verläuft, oder den Streckrezeptornerv direkt auf die Hakenelektrode<br />
legen. Dieser Nerv kann dadurch leicht erkannt werden, daß er unter einem<br />
Luftsack verläuft, der über den Thorakalmuskeln liegt.<br />
- Ableitung kontrollieren, die Amplitude der Aktionspotentiale sollte ca. 1 mV betragen,<br />
bzw. das Signal-Rausch-Verhältnis sollte mindestens 10 : 1 betragen.<br />
Versuchsdurchführung<br />
In diesem Versuch wird ein waagerecht ausgeklappter Flügel als eine 90 o Auslenkung<br />
definiert. Bei 60 o (d.h. 30 o weiter nach unten) hat der Flügel eine stabile Lage (Ruhelage).<br />
1. Flügel in Ruhelage (60 o ) bringen. Antwort des Steckrezeptors 2 min. lang mit<br />
Spike2 aufnehmen <strong>und</strong> Entladungsfrequenz ermitteln.<br />
Von dieser "Ruhelage" ausgehend wird die Entladungsfrequenz des Streckrezeptors nach<br />
Anheben des Flügels gemessen. Zuerst aber sollten Sie eine Tabelle, in der die gemessenen<br />
Werte eingetragen werden können, nach folgendem Muster anfertigen:<br />
57
Auslenk-winkel<br />
5 s 10 s 30 s 60 s<br />
F F F F<br />
F: Entladungsfrequenz (Hz) des Streckrezeptors<br />
2. Versuchen Sie ca. 3 Sätze von Daten <strong>für</strong> mindestens 4 verschiedene Auslenkwinkel<br />
zu gewinnen. (Ideal wäre: 60° - 76° <strong>und</strong> zurück, 60° - 92° <strong>und</strong> zurück, 60° - 108° <strong>und</strong><br />
zurück, 60° - 124° <strong>und</strong> zurück.) Flügel möglichst nicht über 140° heben (Gefahr der<br />
Überdehnung des Streckrezeptors!). Nach der erfolgten Auslenkung Ermittlung der<br />
Entladungsfrequenz zu den Zeiten etwa 5s, 10s, 30s <strong>und</strong> 60s. Nach diesen<br />
Messungen dann den Flügel wieder in die Ausgangslage von 60 Grad zurückführen<br />
<strong>und</strong> warten, bis sich die Frequenz <strong>für</strong> die Ruhelage bei 60 Grad wieder in etwa eingestellt<br />
hat. Werte in eine Tabelle eintragen. Auslenkwinkel messen (ein Rasterpunkt<br />
an der Reizapparatur entspricht einer Auslenkung von 8 0 ). Entladungsfrequenz des<br />
Streckrezeptors in Hz gegenüber der Zeit auftragen.<br />
3. Sie machen einen gleichartigen Versuch, gehen aber zwischen den Auslenkungen<br />
nicht auf die Ruhelage zurück, sondern drehen nach der Messzeit von mind. 60 s bis<br />
zum nächsten Versuchswinkel weiter. Auf diese Weise ergibt sich eine stufenförmige<br />
Reizung des Streckrezeptors. Wie vorher messen Sie die Entladungsfrequenzen der<br />
Streckrezeptoren nach 5, 10, 30 <strong>und</strong> 60 Sek<strong>und</strong>en <strong>und</strong> tragen die Werte wieder in<br />
eine Tabelle ein.<br />
4. Flügel auf die Stellung 124° bringen. Durch einmaliges Drehen der Reizapparatur in<br />
die Ruhelage (60°) zurückklappen. Die Entladungsfrequenz alle 5s bis zur Erreichung<br />
der Ruhefrequenz messen.<br />
5. Flügel aus der Reizapparatur heraus nehmen. Durch vorsichtiges Drehen der Flügel<br />
um ihre Längsachse (Vorderkante nach unten: "Pronation", nach oben: "Supination")<br />
eventuelle Veränderungen der Entladungsfrequenz des Streckrezeptors notieren.<br />
58
Bestimmung der Kennlinien<br />
Mittelwert <strong>und</strong> Standardabweichung der Aktionspotentialfrequenz (Ordinate) gegenüber Zeit<br />
(Abszisse) <strong>für</strong> die verschiedenen Auslenkwinkel auftragen. Kurven einzeichnen, die den<br />
gemessenen Werten <strong>für</strong> jeden Auslenkwinkel am besten beschreiben. Aus dieser Zeichnung<br />
mittlere Frequenz der phasischen (bei ca. 1s) <strong>und</strong> tonischen (bei 60s) Antwort <strong>für</strong> jeden<br />
Auslenkwinkel entnehmen. Tragen Sie diese Werte (Ordinate) gegen den Auslenkwinkel<br />
(Abszisse) auf <strong>und</strong> zeichnen Sie dann die Kennlinie <strong>für</strong> die phasische <strong>und</strong> tonische<br />
Rezeptorerregung getrennt ein.<br />
Die folgenden Fragen dienen zur Überprüfung Ihres Wissens. Sie könnten diese Fragen in<br />
einem Anhang zu Ihrem Protokoll beantworten, sollten Sie Wert darauf legen, Ihre<br />
Antworten von einem/r der Lehrveranstalter/innen korrigiert zu bekommen. Bitte halten Sie<br />
Ihre Antworten kurz <strong>und</strong> prägnant.<br />
Fragen<br />
- Welche Vorgänge laufen zwischen dem Anheben eines Flügels <strong>und</strong> der Auslösung<br />
von Aktionspotentialen im Streckrezeptorneuron ab?<br />
- Wodurch ist die maximale Entladungsrate des Streckrezeptors begrenzt?<br />
- Was verstehen Sie unter phasischen <strong>und</strong> tonischen Rezeptoren? Welche Information<br />
übertragen sie?<br />
- Welche physikalischen Parameter kann der Streckrezeptor messen? In welcher<br />
Form werden diese kodiert?<br />
- Bei einer typischen Flügelschlagfrequenz von 25 Hz entlädt der Streckrezeptor einer<br />
Wanderheuschrecke 1 bis 2 mal pro Aufschlag. Welche Funktionen erfüllt der<br />
Streckrezeptor Ihrer Meinung nach während des aktiven Flugs <strong>und</strong> des Segelflugs, in<br />
turbulenter Luft?<br />
- Worin könnte der Vorteil bestehen, daß die meisten Rezeptoren eine Kennlinie<br />
besitzen, die mit dem Logarithmus der Reizintensität ansteigt?<br />
- Was ist Adaptation? Wie geschieht dies? Welche funktionelle Bedeutung hat sie?<br />
- Was ist der Unterschied zu Habituation?<br />
- Erklären Sie die Veränderung der Entladungsfrequenz des Streckrezeptors beim<br />
Zurückklappen des Flügels.<br />
- Welche Versuche könnte man durchführen, um mehr über die Funktion von Sinneszellen<br />
wie dem Flügelstreckrezeptor zu erfahren?<br />
- Kennen Sie Streckrezeptoren, die bei Wirbeltieren vorkommen?<br />
59
Literatur<br />
Burrows, M. (1975) Monosynaptic connexions between wing stretch receptors and flight<br />
Motoneurons of the locust. J.exp.Biol. 62:189-219.<br />
Nachtigall, W. (1983) Biona Report 2, Insect Flight II, Akad. Wiss. Mainz: G. Fischer Verlag,<br />
Stuttgart, New York.<br />
Pabst, H. & Schwarzkopff, J. (1962) Zur Leistung der Flügelgelenk-Rezeptoren von Locusta<br />
migratoria. Z.verg.Physiol. 45:396-404.<br />
Robertson, R.M. (1992) Sensory adaptation: extracellular recording from locust wing hinge<br />
stretch receptor. Am.J.Physiol. 263:7-11.<br />
60
5. Versuchstag:<br />
Farbensehen (Psychophysische Experimente zum Farbensehen)<br />
Farbempfindungen gehören zu den besonders wichtigen Sinneseindrücken, die wir beim<br />
Betrachten unserer Umwelt haben. Daher begründet sich vielleicht auch das schon sehr alte<br />
Interesse, die Gr<strong>und</strong>lagen <strong>und</strong> Gesetzmäßigkeiten dieser Wahrnehmungen zu erforschen<br />
<strong>und</strong> zu beschreiben. Dieser Praktikumstag soll Ihnen eine Einführung in die dazu benutzten<br />
Methoden, die gr<strong>und</strong>legenden Ergebnisse <strong>und</strong> ihre moderne, physiologische Deutung geben.<br />
Achten Sie darauf, daß die im Skript formulierten Fragen in Ihrem Protokoll beantwortet<br />
werden.<br />
Physiologie des Farbensehens<br />
Farbempfindungen entstehen im Gehirn dadurch, dass emittiertes oder reflektiertes Licht auf<br />
die Retina im Auge fällt <strong>und</strong> von Photorezeptoren absorbiert wird. Über eine Signalkaskade<br />
wird die Information über den Lichtreiz an die nachgeschalteten neuronalen Netzwerke<br />
weitergeleitet. Physikalisch existieren Farben nicht, sondern nur Lichtreize. Farben sind<br />
Wahrnehmungsphänomene, die aus der neuronalen Verschaltung verschiedenartiger Photorezeptoren<br />
entstehen.<br />
1.0<br />
0.8<br />
Spektrale Sensitivität<br />
0.6<br />
0.4<br />
0.2<br />
S<br />
M<br />
L<br />
0.0<br />
400 500 600 700<br />
Wellenlänge (nm)<br />
Abb.1: Die spektralen Empfindlichkeitskurven der menschlichen, am Farbensehen beteiligten Photorezeptoren<br />
(Zapfen): S-, M- <strong>und</strong> L-Rezeptor. Die Bezeichnung leitet sich aus der Lage der Empfindlichkeitsmaxima ab (short<br />
(S), middle (M) <strong>und</strong> long (L) wavelength receptor). Oft werden sie auch nach der menschlichen Farbe des<br />
Spektrallichtes aus dem Wellenlängenbereich, in den die Maxima fallen, benannt: Blau-, Grün- <strong>und</strong> Rotrezeptor.<br />
61
Die menschliche Farbwahrnehmung ist trichromatisch, da drei spektrale Rezeptortypen<br />
beteiligt sind. Im Vergleich zu den meisten Säugern mit einer dichromatischen Farbwahrnehmung,<br />
sind wir fähig, sehr viel mehr Farben zu unterscheiden. Die unterschiedlichen<br />
spektralen Empfindlichkeitsbereiche der Rezeptoren (Abb. 1) sind Voraussetzung <strong>für</strong> ein<br />
Farbsehsystem, jedoch nicht allein ausreichend. Erst die entsprechende neuronale<br />
Verschaltung, ermöglicht die Farbwahrnehmung. Der einzelne Photorezeptor stellt nur einen<br />
farbenblinden Lichtquantenzähler dar. So kann der S-Rezeptor – der also überwiegend im<br />
kurzwelligen Teil des Spektrums empfindlich ist – nicht unterscheiden, ob <strong>und</strong> wieviel der<br />
absorbierten Energie von Lichtquanten mit 420 nm oder 480 nm Wellenlänge stammen. Die<br />
Signale der Photorezeptoren werden in den nachgeschalteten Gegenfarbneuronen dann so<br />
ausgewertet, daß diese Zweideutigkeit verschwindet <strong>und</strong> die spektralen (also Wellenlängenabhängigen)<br />
Eigenschaften des Lichts unabhängig von der Intensität des Lichtreizes<br />
analysiert werden. Gr<strong>und</strong>legendes Merkmal der auswertenden visuellen Neurone ist die<br />
Subtraktion von Rezeptorsignalen, z.B. das M- <strong>und</strong> L-Rezeptorsignal wird positiv verschaltet<br />
<strong>und</strong> das S-Rezeptorsignal negativ (Abb.2). Bei unbunten (achromatischen) Farben, wie<br />
Schwarz, Weiß, Grau, erfolgt die Verarbeitung über Neurone, die die Rezeptorsignale<br />
einfach summieren, <strong>und</strong> daher nicht unterscheiden können, wieviel Erregung von welchem<br />
Rezeptor stammt. Sie sollen informieren, wie intensiv ein Lichtstimulus ist. Die neuronale<br />
Verschaltung der Photorezeptoren führt also dazu, daß es chromatische Neurone (spektral<br />
antagonistisch verschaltete) <strong>und</strong> achromatische Neurone gibt. Letztere erhalten in der Fovea<br />
von allen 3 spektralen Rezeptortypen (S, M, L, siehe Abb. 1) gleichartigen Eingang, außerhalb<br />
der Forea erhalten diese Neurone Eingang von den Stäbchen.<br />
62
+<br />
Abb. 2: Schema der neuronalen Verschaltung im menschlichen Farbsehsystem.<br />
Psychophysik des Farbensehens<br />
In den bisherigen Kurstagen haben Sie sich überwiegend mit der Bildung <strong>und</strong> Weiterleitung<br />
neuronaler Signale beschäftigt sowie Methoden kennengelernt, wie man solche Vorgänge<br />
direkt messen kann. Für viele Fragestellungen war oder ist es jedoch nicht möglich direkte<br />
Messungen an Neuronen oder Gehirn vorzunehmen oder die untersuchten Prozesse sind so<br />
komplex, dass man zunächst nur über Verhaltensexperimente einen Zugang schaffen kann.<br />
In psychophysischen Experimenten kann man untersuchen, wie die Farbwahrnehmung<br />
von den physikalisch beschreibbaren Reizen abhängt. Beim Studium der Sehwahrnehmung<br />
werden die Lichtreize dabei von den Versuchspersonen bezüglich ihrer Gleichheit (Identitätsurteil),<br />
bezüglich des Grades ihrer Verschiedenheit (Ähnlichkeitsurteil) oder bezüglich<br />
63
Qualität beurteilt. Untersucht man das Farbensehen, dann besteht die Beurteilung der<br />
Qualität des Lichtreizes darin festzustellen (in Worten zu beschreiben), um welche Art von<br />
Farben es sich handelt, also ob sie als reine Farben (Urfarben) oder als gemischte Farben<br />
wahrgenommen werden.<br />
Als Urfarben gelten beim Menschen nach Ewald Hering Blau, Gelb, Grün, Rot, Schwarz <strong>und</strong><br />
Weiß. Alle anderen Farbempfindungen enstehen aus der Mischung von Urfarben. Dabei<br />
können Rot <strong>und</strong> Grün bzw. Blau <strong>und</strong> Gelb nie gleichzeitig auftreten, sie scheinen sich<br />
gegenseitig auszuschließen. Deshalb bezeichnet man diese Paare als Gegenfarbenpaare.<br />
Dies gilt nicht <strong>für</strong> das verbleibende Paar der (achromatischen) Urfarben schwarz <strong>und</strong> weiß:<br />
Im Grau können sie gemeinsam auftreten. Gemischte Farben entstehen z.B. aus Gelb <strong>und</strong><br />
Rot (Orange) oder aus Rot <strong>und</strong> Blau (Purpur).<br />
Dieser Vorstellung stand im 19. Jahrh<strong>und</strong>ert die von Thomas Young begründete trichromatische<br />
Theorie des Farbensehens gegenüber, die auf den Erkenntnissen von I. Newton’s<br />
Farbmischexperimenten mit monochromatischen Lichtern basierte <strong>und</strong> von James Maxwell<br />
<strong>und</strong> Hermann von Helmholtz weiter vertieft wurde. Im Mittelpunkt dieser Theorie steht die<br />
Beobachtung, daß sich jede Farbe aus drei in einem spezifischen Intensitätsverhältnis<br />
gemischten sogenannten Primärlichtern (Rot, Grün, Blau) herstellen lässt. Eine weitere<br />
Beobachtung war, daß sich die gleiche Farbe durch verschiedene Lichtmischungen<br />
erzeugen lässt (metamere Farben) <strong>und</strong> daß sich eine geroße Zahl von Farbpaaren zu<br />
Unbunt mischen lassen (Komplementärfarbenpaare). Diese Farbmischungsregeln wurden<br />
mathematisch beschrieben <strong>und</strong> bildeten die Gr<strong>und</strong>lage <strong>für</strong> die Entwicklung von Farbräumen<br />
<strong>und</strong> Farbsehmodellen. Aufgr<strong>und</strong> dieser Betrachtungsweise gelangt man zu 8 Gr<strong>und</strong>farben:<br />
Rot, Grün, Blau, Gelb (Mischung aus Rot <strong>und</strong> Grün), Magenta (Blau <strong>und</strong> Rot), Cyan (Grün<br />
<strong>und</strong> Blau) sowie Schwarz <strong>und</strong> Weiß. Das klingt alles ganz schön verwirrend <strong>und</strong> ist es auch,<br />
denn tatsächlich sind die 4 Urfarben (Blau, Gelb, Rot, Grün, nach der Gegenfarbentheorie<br />
von Hering) <strong>und</strong> die 6 Gr<strong>und</strong>farben (Blau, Gelb, Rot, Grün, Magenta, Cyan, nach der<br />
Young-Helmholtz'schen trichromatischen Theorie) nicht dasselbe, da sich die Bezeichnungen<br />
<strong>für</strong> qualitative Wahrnehmungspähomene (Farben) auf zwei verschiedene Theorien des<br />
Farbensehens beziehen. Tatsächlich stellt sich heraus, daß beide Theorien zutreffend sind,<br />
die trichromatische Theorie auf der Ebene der Rezeptoren <strong>und</strong> die Gegenfarbentheorie auf<br />
der Ebene der neuronalen Verschaltung.<br />
64
Farbräume <strong>und</strong> -diagramme<br />
Man möchte nun Farben nicht nur mit Worten beschreiben können, sondern objektiv mit<br />
numerischen Werten. Wie kann man Farbunterscheidung quantitativ erfassen <strong>und</strong><br />
auswerten? Wie sehen die neuronalen Interaktionen aus, die die Farbwahrnehmung<br />
bewirken? Zunächst einmal versuchen wir die Farbwahrnehmung schematisch zu untergliedern<br />
(Abb.3).<br />
Stufe 1 beschreibt die Absorption der Lichtquanten durch die Photorezeptoren, die entweder<br />
auf den Teststimulus oder einen Referenzstimulus schauen. Die Signale der Photorezeptoren<br />
werden kodiert mit Hilfe von Gegenfarbneuronen <strong>und</strong> intensitätsmessenden<br />
Neuronen (Stufe 2). Als nächster Prozessierungsschritt erfolgt im Gehirn der Vergleich<br />
zwischen zwei kodierten Farben (Stufe 3). Können diese unterschieden werden, kann als<br />
Stufe 4 ein verbales Ähnlichkeitsurteil erfolgen (Mensch) oder eine an die Testfarbe<br />
gekoppelte Verhaltensweise ausgeführt werden (Tier).<br />
Abb.3: Vierstufiges Schema der Farbunterscheidung.<br />
Der von einem Photorezeptor absorbierte Lichtstrom kann wie folgt bestimmt werden: Der<br />
wirksame (absorbierte) Photonenstrom P i (i= einer der drei Zapfentypen, siehe Abb. 1)<br />
berechnet sich aus der spektralen Intensitätsverteilung des beleuchtenden Lichtes I(λ) <strong>und</strong><br />
des von einer Oberfläche reflektierten Lichtes R(λ) sowie den drei spektralen Sensitivitätsfunktionen<br />
S i (λ)<strong>und</strong> einem Adaptationsparameter C:<br />
720<br />
<br />
( λ) R( λ) S ( λ)<br />
Pi = C I<br />
i<br />
dλ<br />
, (1)<br />
380<br />
65
Also gilt <strong>für</strong> jeden der drei spektralen Photorezeptortypen S, M, L:<br />
P<br />
S<br />
=<br />
720<br />
<br />
380<br />
I<br />
( λ) R( λ) S ( λ)<br />
S<br />
dλ<br />
P<br />
P<br />
M<br />
L<br />
<br />
( λ) R( λ) S ( λ)<br />
= I<br />
dλ<br />
<br />
M<br />
( λ) R( λ) S ( λ)<br />
= I<br />
dλ<br />
L<br />
Da die drei spektralen Photorezeptortypen unabhängig von einander arbeiten, hat man drei<br />
Eingangsparameter <strong>für</strong> das Farbsehsystem (Abb. 3, Stufe 1). Daraus kann ein dreidimensionales<br />
Koordinatensystem, ein Farbraum, konstruiert werden (Abb.4), in dem<br />
P M<br />
P L<br />
P S<br />
P M<br />
P S<br />
P L<br />
Abb.4: Der Rezeptorfarbraum.<br />
jeder Farbe ein Farbort mit drei Koordinaten (P S , P M , P L ) zugewiesen werden kann. Dieser<br />
Farbraum ist zugleich der Rezeptorraum, da in unserem Beispiel die Eingangsparameter<br />
über die Rezeptoreigenschaften definiert sind. Der Farbort befindet sich am Ende des Farbvektors<br />
(F), der aus der Nullkoordinate des Koordinatensystems hervorgeht. Die Länge des<br />
Vektors entspricht der Intensität des Lichtstimulus. Dieser dreidimensionale Raum ist überbestimmt,<br />
wenn man an der Intensität des Lichtes (in der Wahrnehmung: der Helligkeit des<br />
Stimulus) nicht interssiert ist, denn diese drückt sich in der Länge des Vektors F aus. Die<br />
66
Farbe aber wird durch den Raumwinkel des Vektors F beschrieben. Man kann also den dreidimensionalen<br />
Raum auf einen zweidimensionalen reduzieren. Dazu muß man die drei<br />
Achsen normieren (z.B. <strong>für</strong> weißes Licht: P S = P M = P L = 1) <strong>und</strong> festlegen, daß man als<br />
"Farbort" f einer Farbe den Durchstoßpunkt des Vektors in der Farbebenebezeichnet. Diese<br />
Farbebene, die zwischen den Normierungspunkten aufgespannt wird, ist ein Dreieck (daher<br />
häufig auch als Farbdreieck bezeichnet). In der Geschichte der Farbsehforschung (die wir<br />
hier nicht nachvollziehen wollen) gab es viele verschiedene "Farbdreiecke", da man die<br />
spektralen Eigenschaften der menschlichen Photorezeptoren nicht kannte. Da diese heute<br />
bekannt sind, kann man sich auf die Farbebene im "RGB-Raum" beziehen, in dem <strong>für</strong> die<br />
Achsen P L , P M <strong>und</strong> P S jeweils die nicht-linearen Transduktionseigenschaften der langwelligen<br />
Rezeptoren (P L ; R), der mittelwelligen (P M ; G) bzw. der kurzwelligen Rezeptoren (P S ; B)<br />
angenommen werden.<br />
In einem solchen Farbdreieck gelten nun einige einfache Regeln:<br />
"G"<br />
P M<br />
500<br />
525<br />
550<br />
575<br />
600<br />
450<br />
400<br />
475<br />
W<br />
625<br />
650<br />
700<br />
"B"<br />
P S<br />
P L<br />
"R"<br />
Abb. 5: Farbdreieck mit Spektralfarbenzug. W – Weißpunkt.<br />
67
Monochromatische Lichter haben ihre Farborte auf dem Spektralfarbenzug (Abb.5). Der<br />
Spektralfarbenzug ist durch eine Mischungsgerade, die Purpurgerade geschlossen<br />
(gestrichelte Linie in Abb. 5). Auf dieser Geraden liegen alle Mischungen der beiden monochromatischen<br />
Lichter an den Enden (blau <strong>und</strong> rot) des <strong>für</strong> den Menschen sichtbaren<br />
Wellenlängenbereichs. Der Spektralfarbenzug ist konvex gekrümmt. (Überlegen Sie warum<br />
dies so ist). Legt man durch den Weißpunkt Geraden, so schneiden diese den Spektralfarbenzug<br />
an jeweils zwei Punkten. Die Schnittpunkte sind die Farborte der monochromatischen<br />
Komplementärlichter, also der Lichter, die im richtigen Verhältnis gemischt<br />
Weißlicht ergeben (additive Farbmischung).<br />
Überlegen Sie: Warum liegen die Farborte von spektral breitbandigen Lichtern (z.B. denen<br />
der Leuchtstoffe einer Farbfernsehröhre) stets innerhalb des Spektralfarbenzuges; warum<br />
sich aus solchen breitbandigen Lichtern nicht jede Farbe mischen läßt (welche nicht?);<br />
warum wir Farben sehen, die keine physikalische Entsprechung in monochromatischen<br />
Lichtern haben (welche sind das?). (Beantworten Sie diese Fragen in Ihrem Protokoll.)<br />
Eine weitere Eigenschaft unserer Farbwahrnehmung läßt sich mit dem Farbendreieck qualitativ<br />
gut beschreiben: betrachtet man Farbstimuli, deren Farborte auf einer Mischungsgeraden<br />
liegen <strong>und</strong> sich vom Weißpunkt immer mehr dem Spektralfarbenzug nähern, dann<br />
erscheinen uns diese zunehmend gesättigt (reiner in der Farbe bei gleichartiger Farbe).<br />
Nimmt man diese Eigenschaft unserer Farbwahrnehmung zu den anderen beiden bereits<br />
dargestellten hinzu, so lassen sich <strong>für</strong> jede Farbe drei qualitative Urteile abgeben: ihre Farbart<br />
(= Ort im Farbendreieck), ihre Helligkeit (= Länge des Vektor sim RGB-Raum), ihre<br />
Sättigung (= Entfernung vom Weißpunkt).<br />
Der RGB-Farbraum <strong>und</strong> das Farbendreieck eignen sicht gut, um die Gleichheit von zwei<br />
Farbstimuli zu bestimmen: ihre Farborte müssen dann genau übereinander liegen. Weniger<br />
gut geeignet sind diese Darstellungsweisen, um Farbunterschiede zu quantifizieren. Das<br />
liegt daran, daß an der Farbwahrnehmung eine Reihe nicht-linearer Prozesse beteiligt sind,<br />
die deswegen nur annäherungsweise mit der linearen Geometrie des RGB-Farbraums<br />
beschreibbar sind. Außerdem beschreiben der RGB-Farbraum <strong>und</strong> das Farbendreieck nicht<br />
die von Hering gef<strong>und</strong>enen Phänomene der Gegenfarben. Das ist auch nicht verw<strong>und</strong>erlich,<br />
weil diese Wahrnehmungsphänomene auf die neuronale Verschaltung der Rezeptoreingänge<br />
zurückgehen. Es liegt daher nahe, ein Farbsehmodell auf Annahmen solcher<br />
neurnalen Verschaltungen aufzubauen. Damit sollten sich auch Farbunterschiede besser<br />
quantifizieren lassen.<br />
68
Ein Beispiel da<strong>für</strong> ist der L*a*b*-Farbraum (Abb. 6), der 1976 von der CIE (Commission<br />
Internationale d'Eclairage) eingeführt wurde. a* <strong>und</strong> b* versteht man als Äquivalent <strong>für</strong> die<br />
zwei Gegenfarbmechanismen, die beim Menschen bekannt sind (Rot-Grün <strong>und</strong> Blau-Gelb).<br />
L* steht <strong>für</strong> die Helligkeit einer Farbe. Durch diese Weiterentwicklung wurde die mathe-<br />
Abb. 6: Der CIE L*a*b*-Farbkörper.<br />
matische Beschreibung der Farbwahrnehmung besser an die Funktionsweise des menschlichen<br />
Sehsystems angepasst. Jede Farbe hat auch hier drei Koordinaten (L*,a*,b*).<br />
Berechnet man die Koordinaten der Farborte von zwei verschiedenen Lichtstimuli, läßt sich<br />
der Abstand zwischen den beiden Punkten berechnen, der jetzt dem beim Betrachten der<br />
zwei Lichtstimuli subjektiv wahrgenommenen Unterschied (∆E* ab ) sehr viel besser entspricht:<br />
∆<br />
*<br />
E ab<br />
=<br />
* 2 * 2 *<br />
( ∆L<br />
) + ( ∆a<br />
) + ( ∆b<br />
) 2<br />
Additive <strong>und</strong> subtraktive Farbmischung<br />
Die Überlagerung von Lichtstimuli bezeichnet man als additive Farbmischung, d.h. ein<br />
gleichzeitiges Zusammenwirken von Farbreizen auf der Retina (Abb. 7a). Die additiven<br />
Gr<strong>und</strong>farben sind Rot, Grün, Blau. Unser Auge löst die Leuchtpunkte eines Farbmonitors bei<br />
normalem Betrachtungsabstand (ca. 30cm) nicht räumlich auf. Das Licht, das die drei<br />
Leuchtpunkte eines Bildpunktes beim Auftreffen des Elektronenstrahls auf dem Bildschirm<br />
aussenden, stellt <strong>für</strong> die Photorezeptoren der Retina also eine additive Lichtmischung dar.<br />
Die Gesetze der additiven Lichtmischung können deshalb auch auf einem Computer mit<br />
Farbmonitor gezeigt werden. Verändert man die drei Elektronenströme des Farbmonitors<br />
(relative R,G,B-Werte), so verändern sich die Lichtintensitäten I des von den Leuchtstoffen<br />
ausgesandten Lichts <strong>und</strong> damit der wirksame Photonenstrom in den drei Photorezeptoren.<br />
Da der ausgesandte Lichtstrom exponentiell mit den R,G,B-Werten zunimmt (Bildröhren-<br />
69
Gamma-Funktion: I ~ 10 R,G,B ), steigt die Erregung in den Photorezeptoren <strong>und</strong> damit der<br />
subjektive Helligkeitseindruck etwa linear mit den R,G,B-Werten an. Warum ist das so? Die<br />
R,G,B-Werte sind so normiert, daß die Gesamtleuchtdichte <strong>für</strong> Weiß Y max = R max + G max<br />
+ B max ist <strong>und</strong> dabei R max = G max = B max . Da der Helligkeitseindruck nach dem<br />
Fechnerschen Gesetz näherungsweise logarithmisch von der Lichtintensität abhängt, sinkt<br />
also bei Halbierung der R,G,B-Werte auch der Helligkeitseindruck der jeweiligen Farbe<br />
näherungsweise auf die Hälfte.<br />
Subtraktive Farbmischung entsteht dann, wenn von vorhandener Strahlungsenergie durch<br />
Absorption (Farbpigment) ein Teil entnommen wird (Abb. 7b). Legt man z.B. zwei Farbpigmentkörnchen<br />
beim Menschen von Pigmentfarben übereinander, dann wird nur der Teil<br />
des Lichtspektrums reflektiert, der von keinem der beiden Pigmentkörnchen absorbiert wird.<br />
Überlegen Sie auch: Warum füllt der Farbraum, der mit den Bildpunkten des Monitors<br />
erzeugt werden kann, nur so einen geringen Teil des theoretisch möglichen Farbraumes<br />
aus?<br />
70
a)<br />
1.1<br />
1.0<br />
Blau<br />
Additive Farbmischung<br />
Wahrnehmung: Weiss<br />
Gelb<br />
0.9<br />
0.8<br />
Reflektion/Emission<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0.0<br />
400 500 600 700<br />
Wellenlänge (nm)<br />
b)<br />
1.1<br />
Subtraktive Farbmischung<br />
1.0<br />
0.9<br />
0.8<br />
Gelbpigment<br />
Blaupigment<br />
Absorption<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
Wahrnehmung: Grün<br />
0.0<br />
400 500 600 700<br />
Wellenlänge (nm)<br />
Abb. 7: a) Additive Farbmischung; b) Subtraktive Farbmischung.<br />
Simultaner <strong>und</strong> sukzessiver Farbkontrast<br />
Die simultane Hemmwirkung benachbarter Sehbereiche ist Ihnen <strong>für</strong> Schwarz/Weißmuster<br />
bereits bekannt (Machbänder, Herrman'sche Gittertäuschung, laterale Inhibition). Sie führt zu<br />
einer Kontrastüberhöhung. Dem simultanen Farbkontrast liegt ein vergleichbarer<br />
Mechanismus zugr<strong>und</strong>e, der die Verschaltung visueller Neurone im Sehcortex wiederspiegelt.<br />
Im Unterschied zur Schwarz/Weiß-Kontrastüberhöhung ist die Farbkontrastüber-<br />
71
höhung kein lokaler Effekt in den Randbereichen der Flächen, sondern ein großflächiger<br />
Effekt (Abb. 8a, b).<br />
Der sukzessive Farbkontrast beruht auf der selektiven spektralen Adaptation von Gegenfarbenneuronen<br />
der Retina, die durch das Fixieren von Reizlichtern entsteht. Darum kann<br />
man Nachbilder bei Augenbewegungen mitbewegen.<br />
Inhibition<br />
R+ / G-<br />
R+ / G-<br />
-<br />
Inhibition<br />
Abb. 8: a. Wechselseitige Hemmung von Gegenfarbenneuronen zur Erklärung des simultanen Farbkonstrastes<br />
(antagonistische Verschaltung). b. Der Flächenkontrast kommt dadurch zustande, daß viele Gegenfarbenneurone<br />
in vielfältiger Weise antagonistisch miteinander verschaltet sind.<br />
Experimente<br />
1) Ordnen Sie die Farbstimuli im Kreis an. Erklären Sie, nach welchem Prinzip Ihre<br />
Anordnung zustande kam. Farbenkreis<br />
Vergleichen Sie Ihren Farbkreis mit dem fertigen Beispielkreis. Fertiger Farbenkreis<br />
2) Farbmischung mit RGB-Werten (0-100%) des Farbmonitors. Versuchen Sie, die<br />
Gr<strong>und</strong>farben herzustellen sowie ein mittleres Grau. Welche Art der Farbmischung<br />
wenden Sie an? Warum erhalten Sie ein mittleres Grau mit den von Ihnen<br />
bestimmten Mischproportionen? RGB Monitor<br />
3) Wählen Sie im Programm IPXL unter „Select“-„Experiments“ „Simple colored disk“.<br />
Schalten Sie die Option „Options“-„Follow invalid colors“ aus. Lassen Sie sich die<br />
Koordinaten <strong>für</strong> yxy <strong>und</strong> Lab anzeigen („Systems“). Schauen Sie sich Yyx <strong>und</strong> Lab<br />
Farbraum an. Wo liegt der Weißpunkt im Yyx <strong>und</strong> im Lab? Stellen Sie die Intensität<br />
so ein, dass im Diagramm die graue Fläche ein Dreieck bildet. Was stellt es dar? Was<br />
ist der Unterschied zwischen Farborten innerhalb der grauen Fläche <strong>und</strong> außerhalb<br />
der grauen Fläche?<br />
72
Verändert sich der Weißpunkt bei Veränderung der Intensität? Verändern Sie Farbton,<br />
Sättigung, Helligkeit des Farbstimulus <strong>für</strong> verschiedene Gr<strong>und</strong>farben.<br />
Vermindern Sie die Sättigung des Stimulus bei konstanter Intensität. Was passiert mit<br />
der subjektiven Intensität des Stimulus?<br />
Stellen Sie verschiedene Intensitäten des Stimulus ein. Beschreiben Sie die<br />
systematische Veränderung.<br />
Verändern Sie die Intensität des Hintergr<strong>und</strong>es von dunkel zu hell. Verkleinern Sie<br />
den Farbstimulus (unter „View“-„Geometry“), <strong>und</strong> wiederholen Sie den Vorgang.<br />
Beobachten Sie einen Wechsel in der subjektiven Intensität des Stimulus?<br />
Versuchen Sie den Bezold-Brücke-Effekt (Veränderung des Farbtons bei großen<br />
Intensitätsunterschieden) zu demonstrieren.<br />
(Sie können die Werte auch direkt im Koordinatenfeld (unten) verstellen, indem Sie<br />
Zahlenwerte eingeben <strong>und</strong> die Enter-Taste betätigen).<br />
IPXL Vision Demo<br />
4) Wählen Sie im Programm CVD „Color top“. Erstellen Sie je eine Farbenreihe mit<br />
konstanter Sättigung <strong>und</strong> Helligkeit, konstanter Sättigung <strong>und</strong> Farbton, oder<br />
konstantem Farbton <strong>und</strong> Helligkeit. Wie sind Sie vorgegangen? CVD<br />
5) Wählen Sie in IPXL “Select”-„Photometry and Mixture“ „Matching and spatial mixture“<br />
oder “Spatial color mixing”. Wählen Sie <strong>für</strong> das linke Viereck eine neue Farbe aus,<br />
<strong>und</strong> versuchen Sie diese im rechten Viereck (feines Streifenmuster aus zwei Farben)<br />
nachzumischen. Kann Ihnen der Farbraum dabei behilflich sein? Wo befindet sich der<br />
Farbort der Mischfarbe relativ zu den zwei Einzelfarben? Welche Art von Mischung<br />
haben Sie angewandt?<br />
Versuchen Sie nun eine metamere Farbe aus 2 Paaren von Farben zu mischen.<br />
Sie können die Bildansicht vergrößern (unten Mitte, Button „Full“). IPXL Vision Demo<br />
6) Versuchen Sie den Farbabstand zwischen zwei Farben zu schätzen. Wählen Sie im<br />
Programm CVD „CIE Lab“. Stellen Sie die zwei Ausgangsfarben auf isoluminant ein.<br />
Verringern Sie den Farbabstand ∆E zur Testfarbe (jeweils doppelt mit verschiedenen<br />
Farborten) <strong>und</strong> schätzen Sie den Farbunterschied. CVD<br />
7) Simultaner Farbkontrast: Wählen Sie in IPXL „Select“-„Simple contrast effects”<br />
“Simultanous color contrast”. Schauen Sie sich die inneren Vierecke einzeln an,<br />
indem Sie den Button “Step” bedienen. Was beobachten Sie?<br />
73
Stellen Sie die Farbe der äußeren Felder auf solche Werte ein, die die beiden inneren<br />
Felder möglichst verschiedenen aussehen lässt. Unter welchen Umständen gelingt<br />
das besonders gut? IPXL Vision Demo<br />
8) Sukzessiver Farbkontrast: Wählen Sie in IPXL “Adaptation effects”-“Aftereffects and<br />
Opponent Colors”. Adaptieren Sie an die Farbstimuli, indem Sie 0,5-1 Minute das<br />
Kreuz in der Mitte fixieren. Mit dem Button „Step“ (unten links) entfernen Sie die<br />
Farbfelder. Beobachten Sie die Nachbilder. Wenn Sie ein gutes Nachbild haben,<br />
versuchen Sie es auf eine weiße Fläche (Papier, Wand) oder eine bunte Fläche zu<br />
legen. Sie können sich dabei entfernen oder annähern. Was passiert?<br />
Beobachten Sie Nachbilder anhand der Bilder in „Induction“, „Desaturation by<br />
Adaptation“ <strong>und</strong> „Hypersaturation“ (2x „Step“). IPXL Vision Demo<br />
Weitere Aufgaben:<br />
9) Text <strong>und</strong> Hintergr<strong>und</strong>: Wählen Sie im Programm CVD “Readibility of colored letters“.<br />
Wann ist die Lesbarkeit am besten? CVD<br />
10) Beschreiben Sie die Farbe der U-Form. Sie können durch Mouseklick die RGB-Werte<br />
(0-100%) verstellen. Verändert sich die Farbwahrnehmung, wenn Sie die Farbe der<br />
Querstreifen verändern? Versuchen Sie diese Veränderung zu unterbinden. Welches<br />
Phänomen erklärt die Wahrnehmungsveränderung? Farbenmuster<br />
11) Wählen Sie in IPXL „Select“-„Experimental methods“ „Induction and Matching“. Unter<br />
“View”-Geometry” stellen Sie die Größe der Streifen auf 1. Wählen Sie <strong>für</strong> das linke<br />
Viereck eine Farbe aus <strong>und</strong> gleichen Sie das rechte Viereck an. Berechnen Sie den<br />
Farbunterschied. Versuchen Sie nun den Einfluß einer zweiten Farbe im Farbmuster<br />
auf die Farbidentität zu testen, indem Sie die Breitenstreife auf mittel <strong>und</strong> dünn einstellen.<br />
Berechnen Sie auch hier die Unterschiede <strong>und</strong> vergleichen Sie diese. Testen<br />
Sie, ob verschiedene Farbkombinationen (d.h. Farben mit großem <strong>und</strong> kleinem Farbabstand)<br />
eine unterschiedliche Wirkung auf das Matching-Ergebnis haben. Wiederholen<br />
Sie das Experiment mit einer zweiten Farbkombination.<br />
Gehen Sie nun auf „Select“-„Introductory displays“ “Simple Center and Surro<strong>und</strong><br />
Field” <strong>und</strong> wiederholen Sie das Matching-Experiment mit den gleichen Farben.<br />
Vergleichen Sie den Einfluß der zweiten Farbe bei dieser Anordnung.<br />
IPXL Vision Demo<br />
74
12) Wählen Sie in IPXL „Select“-„Simple contrast effects” “Color contrast”. Sie können die<br />
Bildansicht vergrößern (unten Mitte, Button „Full“). Mit Hilfe des Button „Step“ (unten<br />
links) können Sie die farbigen Vierecke verschwinden lassen. Wann ist die Farbinduktion<br />
am stärksten? Testen Sie den Effekt auch, wenn die Farben isoluminant<br />
sind (gleiche Helligkeitskoordinate). Spielt die Dicke des „U“ eine Rolle („View“-<br />
„Geometry“). IPXL Vision Demo<br />
Literatur<br />
Backhaus, W. et al. (Hrgs.), 1998. Colour Vision: Perspectives From Different Disciplines.<br />
De Gruyter, Germany<br />
Campenhausen, C. von , 1993. Die Sinne es Menschen. 2. Aufl. G. Thieme Verlag, Stuttgart.<br />
Kap. 8<br />
Gegenfurthner, K., Sharpe, L.T. (Hrgs), 1999. Color Vision: From Genes to Perception. CUP<br />
Hurvich, L.M., 1981. Color Vision. Sinauer, S<strong>und</strong>erland.<br />
Schmidt, R.F. & Thews, G. (Hrgs.), 1987. Physiologie des Menschen. Springer, Berlin.<br />
Wyszecki, G. & W.S. Stiles, 1982. Color Science. Concepts and Methods, Quantitative Data<br />
and Formulae (2nd ed). Wiley, New York.<br />
75
6. Versuchstag:<br />
Simulation neuronaler Netzwerke<br />
An diesen Kurstag werden wir verschiedene Prinzipien synaptischer Übertragung an einem<br />
simulierten neuronalen Netzwerk veranschaulichen. Hierzu werden Sie mit Hilfe eines<br />
Computerprogramms die Rhythmogenese in einem künstlichen Nervennetzwerk analysieren.<br />
Wozu dienen Computersimulationen in der <strong>Neurobiologie</strong>? Zunächst müssen die<br />
wesentlichen Neuronen eines Netzwerkes identifiziert sein, ihre physiologischen<br />
Eigenschaften (Ionenströme, Aktionspotentiale, Transmitter) <strong>und</strong> die synaptischen<br />
Verschaltungen untereinander experimentell aufgeklärt sein. Dann kann es sinnvoll sein,<br />
Hypothesen über ihr Zusammenwirken in einem Netzwerk in einer Computersimulation<br />
mathematisch durchzuspielen. Das hat einige Vorteile: 1.) Hypothesen, die sich aus den<br />
experimentellen Arbeiten ableiten lassen, können mathematisch überprüft werden; 2.) die<br />
Vollständigkeit der Datenerhebung kann getestet werden; 3.) Vorhersagen über das<br />
biologische System, die sich aus Modellrechnungen ableiten lassen, können im Experiment<br />
überprüft werden; 4.) die Zahl der Tierexperimente kann u. U. verringert werden.<br />
Neuronale Schaltkreise<br />
Auch wenn sich die Gehirne <strong>und</strong> Nervensysteme von Organismen in vielen Aspekten unterscheiden,<br />
erfüllen alle ihre Funktion dadurch, dass die Neurone in einem Netzwerk kommunizieren.<br />
Nervensysteme bestehen aus vielen Tausenden oder Millionen von Nervenzellen, die<br />
über Synapsen miteinander vernetzt sind. Im Durchschnitt kontaktiert ein zentralnervöses<br />
Neuron andere Neurone mit tausenden synaptischen Verbindungen <strong>und</strong> empfängt<br />
Erregungen aus etwa gleich vielen Verbindungen mit anderen Neuronen. Daher besitzt das<br />
menschliche Gehirn, das r<strong>und</strong> 10 11 Neurone enthält, ungefähr 10 14 Verbindungen.<br />
Die chemische Synapse, der Ort der Signalübertragung zwischen zwei kommunizierenden<br />
Zellen, besteht aus drei Elementen: der präsynaptischen Endigung, der postsynaptischen<br />
Zellmembran <strong>und</strong> dem synaptischen Spalt. Chemische Synapsen können in Abhängigkeit<br />
von ihrem Transmitterrezeptor exzitatorisch (erregend) oder inhibitorisch (hemmend)<br />
wirken.<br />
Viele Erkenntisse über erregende Synapsen wurden an der neuromuskulären Endplatte<br />
der Wirbeltiere gewonnen. Von den Motoneuronen wird der Transmitter Acetylcholin (ACh)<br />
ausgeschüttet. Postsynaptisch wirkt ACh an der Muskelmembran an einem spezialisierten<br />
76
Transmitterrezeptor, dem nikotinischen Acetylcholinrezeptor. Dieser ionotrope Rezeptor ist<br />
etwa gleich permeabel <strong>für</strong> die Kationen Natrium <strong>und</strong> Kalium. Durch die Aktivierung von ACh-<br />
Rezeptoren tritt ein Netto-Einstrom positiver Ladungen ein, wodurch eine Depolarisation der<br />
Membran hervorgerufen wird. Erregende Synapsen im Zentralnervensystem von Vertebraten<br />
benutzen meist Glutamat als Transmitter.<br />
Bei vielen inhibitorischen Synapsen besteht die Wirkung des Neurotransmitters darin, die<br />
Leitfähigkeit der postsynaptischen Membran <strong>für</strong> Chlorid oder Kalium zu erhöhen. Der<br />
Einstrom von Chloridionen (welches Nernstpotential hat Chlorid?) bewirkt eine<br />
Hyperpolarisation der postsynaptischen Membran. Das wirkt einer (an anderer Stelle durch<br />
eine exzitatorische Synapse verursachten) Depolarisation der Zelle entgegen oder es erhöht<br />
die Schwelle zur Auslösung eines Aktionspotentialen. Eine zweite Art der Hemmung ist die<br />
präsynaptische Inhibition. Bei dieser wird auf die präsynaptische Nervenzelle eine<br />
hemmende Transmittersubstanz ausgeschüttet. Diese hyperpolarisiert die Zelle <strong>und</strong> wirkt der<br />
Transmitterfreisetzung aus der präsynaptischen Endigung entgegen. Beispiele <strong>für</strong><br />
inhibitorisch wirkende Transmitter sind GABA <strong>und</strong> Glycin.<br />
Das Zusammenspiel der beschriebenen Mechanismen, die funktionale Anordnung<br />
einfachster neuronaler Bausteine wie exzitatorische, inhibitorische oder modulatorische<br />
Schaltkreise, die einfach oder in Rückkopplungsschleifen miteinander verschaltet sein<br />
können, macht die Funktion der neuronalen Netzwerke aus, in denen Eingänge aus<br />
verschiedenen Bereichen des Nervensystems verrechnet werden <strong>und</strong> die so<br />
unterschiedliche Erregungsmuster generieren.<br />
Eine Beispiel <strong>für</strong> relativ einfache motorische Netzwerke sind die zentralen<br />
Mustergeneratoren (ZMG, oder central pattern generators, CPG), wie wir sie schon bei der<br />
Generation des Flügelschlags bei der Heuschrecke kennengelernt haben. ZMG stellen<br />
neuronale Schaltkreise dar, deren rhythmische Ausgänge vor allem auf intrinsischen<br />
Eigenschaften des Nervennetzes beruhen, d. h., die rhythmische Aktivität kann auch ohne<br />
sensorische Eingänge erhalten bleiben. Meist gibt es eine Interaktion zwischen ZMG <strong>und</strong><br />
sensorischer Information, die bewirkt, dass sich z.B. die Frequenz des Musters den<br />
Umweltbedingungen anpaßt.<br />
Die zellulären Prozesse, auf denen die Rhythmizität eines Netzwerkes basiert, lassen sich<br />
mit Computerprogrammen simulieren <strong>und</strong> analysieren. Der folgende Teil gibt Ihnen eine<br />
Einführung in ein solches Programm.<br />
77
Das Programm SNNAP<br />
Das Program, welches wir einsetzen heißt SNNAP (Simulator for Neural Networks and<br />
Action Potentials, http://snnap.uth.tmc.edu/). SNNAP wurde an der Universität von Texas,<br />
Houston, zu Forschungszwecken <strong>und</strong> <strong>für</strong> die Lehre entwickelt <strong>und</strong> ist frei erhältlich. Für den<br />
User sind alle Parameter <strong>und</strong> Formeln, die zur Simulation implementiert sind, wählbar <strong>und</strong><br />
einsehbar <strong>und</strong> sollen während des Kurses auch als Bestandteil des Protokolls analysiert<br />
werden<br />
In diesem Programm – zumindest in der Herangehensweise, mit der wir uns im Praktikum<br />
beschäftigen können – geht man von sehr einfachen neuronalen Netzen aus. Dadurch ist die<br />
Aktivität jeder Zelle des Netzwerkes ohne weiteres messbar <strong>und</strong> beeinflussbar.<br />
Gehen wir von einfachen Verbindungen (*.ntw→ network), bestehend aus einheitlichen<br />
Zellen (*.neu→ neuron) aus, so können wir daraus innerhalb weniger Schritte ein komplexes<br />
Netzwerk erstellen. Die Eigenschaften jedes einzelnen Neurons lassen sich auf vielfältige<br />
Weisen verändern. Genannt seien hier nur die Ströme, die wir in der Hodgkin-Huxley-<br />
Simulation kennengelernt haben (*.vdg→voltage dependent conductance (G)). Mit diesen<br />
werden wir uns heute eingehender beschäftigen. Man kann jedoch auch von außen – wie im<br />
Hodgkin-Huxley-Experiment – künstlich in ein Netzwerk eingreifen, indem man einen Strom<br />
in eine oder mehrere Zellen injiziert (*.trt→treatment). So kann man Neurone gezielt<br />
stimulieren <strong>und</strong> sich durch die evozierten Antworten ein Bild von den Verschaltungen<br />
innerhalb des Netzwerkes machen. Dies ist Inhalt der dritten Aufgabe des heutigen<br />
Praktikumstages.<br />
Die SNNAP Programm-Hierarchie:<br />
- Simulation (*.smu)<br />
- Behandlung (*.trt)<br />
- Darstellung (*.ous)<br />
- Netzwerk (*.ntw)<br />
- Zellen (*.neu; *.cell) <strong>und</strong> Synapsen (*.cs; *.ms)<br />
- Second-Messenger (*.sm) , Ionen (*.ion) - <strong>und</strong> Transmitter-Pools (*.tr)<br />
- Kanäle/Leitfähigkeiten (*.vdg)<br />
- Aktivierungs- <strong>und</strong> Inaktivierungsparameter, Zeitkonstanten<br />
78
Das Hauptmenü<br />
Über dieses Fenster lassen sich alle Parameter ansteuern <strong>und</strong> verändern.<br />
Modifikation der Simulation:<br />
- ‘Run Simulation’: Öffnet das Auswertungsfenster der Simulation.<br />
- ‘Edit Simulation’: Öffnet die Eingabemaske zur Zusammenstellung der einzelnen<br />
Simulationsparameter.<br />
-<br />
- ‘Edit Outscreen’: Öffnet das Fenster zur Einrichtung der<br />
Koordinatensysteme <strong>und</strong> damit die auswertbaren Daten<br />
in ‘Run Simulation’<br />
Abb. 2: Das Hauptmenü<br />
Erstellung der einzelnen Simulationsparametern:<br />
- ‘Edit Network’: Öffnet das Fenster zur Konstruktion<br />
eines neuronalen Netzwerkes.<br />
- ‘Edit Neuron’: Öffnet das Fenster zur Modellierung von<br />
Zellen.<br />
- ‘Edit Treatment’: gibt die Möglichkeit, eine<br />
Strominjektion in einzelne Zellen des Netzwerkes aus<br />
‘Edit Neuron’ zu<br />
simulieren<br />
Dabei werden wir uns im Rahmen des Praktikums nur mit den angekreuzten Modifikationsmöglichkeiten<br />
befassen. ‘View Data’ <strong>und</strong> ‘Edit Batch’ werden also nicht gebraucht.<br />
79
Abb.3: Die Benutzeroberflächen hinter ‘Edit Formula’ am Beispiel der Modifikation des<br />
spannungsabhängigen Kaliumstromes<br />
Edit Formula<br />
Dieser Knopf führt in die Tiefe des Programms. Hier können die einzelnen Parameter der<br />
Simulationsparameter modifiziert werden. Wir werden uns in dieser Richtung nur mit der<br />
Variation von Parametern der spannungsabhängigen Membranströme (*.vdg) <strong>und</strong> die der<br />
chemischen Synapsen beschäftigen, die vielen Möglichkeiten machen jedoch auch so schon<br />
die große Flexibilität dieser Simulation deutlich.<br />
Edit Neuron<br />
Abb. 3: Neuron-Editor<br />
In dieser Maske kann man sich einen Überblick über die<br />
Parameter machen, die <strong>für</strong> die Simulation eines Neurons<br />
implementiert wurden. Da wir nur auf der Gr<strong>und</strong>lage von<br />
vorprogrammierten „Standardneuronen“ arbeiten werden, ist<br />
<strong>für</strong> uns nur das Feld ‚conductances’ von Bedeutung. Hier<br />
werden die Eigenschaften der spannungsabhängigen Kanäle<br />
angezeigt, welche die Permeabilität der Neuronenmembran<br />
ausmachen. Klickt man in der Liste ‚Conductances’ auf einen<br />
der Kanaltypen, kann man sich über ‚Edit’ → ‚Modify’ die<br />
dahinter stehende Gleichung anzeigen lassen <strong>und</strong> diese<br />
gegen eine andere austauschen, um so die Charakteristika,<br />
wie Spikedauer <strong>und</strong> -wahrscheinlichkeit, Ruhepotential oder<br />
AP-Auslösungsschwelle des Neurons zu verändern. Unter<br />
80
‚General’ finden sich ebenfalls auf ähnliche Weise modifizierbare Parameter, doch werden<br />
wir diese heute nicht behandeln.<br />
Edit Network<br />
In diesem Fenster lässt sich ein Netzwerk, also ein<br />
Verb<strong>und</strong> aus mehreren Zellen modifizieren. Unter<br />
‚Neurons’ werden die beteiligten Neurone angezeigt, die<br />
– entsprechend der Funktion im Neuroneditor – über<br />
‚Edit’→ ‚Modify’ verändert werden können.<br />
Unter ‚Edit’ findet man auch<br />
die Option ‚Add Neuron’,<br />
mit der neue Zellen – in<br />
unserem Falle H&H<br />
(Hodgkin & Huxley) – in das<br />
Abb.4: Networkeditor<br />
Abb.5: Add Neuron Netzwerk eingefügt werden<br />
können. Dazu gibt man<br />
unter ‚Cell name’ einen beliebigen Namen an, unter dem man die Zelle in der Simulation<br />
wiederfinden kann; in das Feld ‚File name’ trägt man entweder den Namen des ‚*.neu-Files’<br />
ein oder nutzt den Browser ‚...’ , um die entsprechende Datei in den Ordnerstrukturen zu<br />
suchen. Die Farben sind frei zu wählen <strong>und</strong> nur eine Hilfe zur Übersichtlichkeit der<br />
Netzwerke.<br />
In der Spalte ‚Conductances’ sind die einzelne synaptischen Verbindungen zwischen den<br />
Zellen aufgezeichnet, wobei die offene Pfeilspitze in Richtung der postsynaptischen Zelle<br />
zeigt. Die Abkürzung ‚[conv]’ steht <strong>für</strong> eine konventionelle – sprich exzitatorische – Synapse,<br />
während ‚[GABA]’ <strong>für</strong> eine inhibitorische Synapse steht. Diese Beschriftungen sind bei der<br />
Erstellung der Synapsen (‚Edit’ → ‚Add Connection’ → ‚Add Chemical’) frei wählbar,<br />
erleichtern aber bei sinnvoller Benennung die Arbeit am Netzwerk ungemein.<br />
81
Edit Treatment<br />
Innerhalb dieses Fensters kann man die von außen an<br />
das Netzwerk angelegten Ströme definieren. Dabei<br />
stehen in der Spalte ‚Neurons’ die betroffenen Neurone<br />
<strong>und</strong> in der Spalte ‚cinj’ (‚current injection’) die Parameter,<br />
angeführt vom Namen des beeinflussten Neurone, in<br />
eckigen Klammern gefolgt von der Einschaltzeit, der<br />
Ausschaltzeit <strong>und</strong> der Amplitude der Strominjektion. Klickt<br />
man eine solche Zeile an, kann man analog zum<br />
Neuroneditor die Parameter modifizieren. Zusätzliche<br />
Treatments erstellt man über ‚Edit’→ ‚Add Treatment’→<br />
Abb.6: Treatmenteditor<br />
‚Add CINJ’. Zentral wird die Behandlung graphisch<br />
dargestellt, wobei alle Treatments, die sich auf das gleiche Neuron beziehen, in ein<br />
Koordinatensystem geschrieben werden. Die anderen Felder auf der linken Seite sind <strong>für</strong><br />
uns innerhalb des Praktikums ohne Belang.<br />
Edit Simulation<br />
Mittels diesen Fensters setzt man die eigentliche<br />
Simulation aus den einzelnen Komponenten zusammen.<br />
Wir befinden uns hier also am virtuellen Setup, dem<br />
eigentlichen Versuchsaufbau. Hier werden die einzelnen<br />
Versuchsparameter festgelegt, wobei wir uns auf die<br />
Parameter ‚Network’, ‚Output_Setup’ <strong>und</strong> ‚Treatment’<br />
beschränken.<br />
Nachdem man also hier eine Simulation geladen hat kann<br />
man o.g. Parameter durch Klicken auf den<br />
entsprechenden Button durch andere austauschen, die<br />
man über die entsprechenden Editoren modifiziert hat.<br />
Abb.7: Simulationseditor<br />
82
Run Simulation<br />
In diesem Fenster können die<br />
Ergebnisse unserer virtuellen Ableitung<br />
dargestellt werden. Nachdem die<br />
Simulation geladen worden ist (‘load<br />
simulation’), kann sie mittels Start-Button<br />
durchlaufen lassen. Über ‚Edit’ → ‚Modify<br />
Simulation’ kommt man direkt in den<br />
Simulationseditor <strong>und</strong> kann dort<br />
Veränderungen an der aktuellen<br />
Simulation vornehmen. Dabei ist darauf<br />
Abb. 8: die Simulation<br />
zu achten, dass diese Veränderungen<br />
erst in ‚Run Simulation’ berücksichtigt<br />
werden, wenn die veränderte Simulation gespeichert <strong>und</strong> die Simulation über ‚Edit’ →<br />
‚Reload Simulation’ neu geladen wurde.<br />
Fehlersuche <strong>und</strong> -behebung<br />
Da dieses Programm nicht von professionellen Programmierern sondern von Neurowissenschaftlern<br />
der Universität Houston, Texas zu Forschungszwecken programmiert wurde,<br />
enthält das Programm noch einige Fehlerquellen. Dies läßt sich leicht feststellen, indem man<br />
den Schritt, an dem man hängen bleibt von Gr<strong>und</strong> auf wiederholt. Eine eingebaute<br />
Fehlermeldung bei Absturz ist leider auch noch nicht implementiert. Hierzu dient die im<br />
Hintergr<strong>und</strong> laufende Command.com, die im Falle eines Zusammenbruchs des Programms<br />
eine kleine Fehlermeldung angibt, nach der sich die meisten Fehler beheben lassen.<br />
Alle benötigten Dateien finden sich in dem Ordner ‚bioinf’, in dem sich <strong>für</strong> jedes Experiment<br />
ein eigener Ordner befindet. Es sollte darauf geachtet werden, dass man immer die Dateien<br />
aus dem zum Experiment gehörenden Ordner nutzt, da in diesen die Parameter auf die<br />
entsprechenden Umfelder abgestimmt sind.<br />
Sollte die batch-Datei ‚start_snnap.bat’ nicht funktionieren, so lässt sich snnap auch direkt<br />
aus der Eingabeaufforderung starten, indem man in den Ordner wechselt, in dem die<br />
SNNAP Dateien liegen <strong>und</strong> dort ‚java –jar snnapVERSION#.jar’ eingibt (Z.B. snnap71.jar<br />
oder snnap8.jar.<br />
83
Literatur:<br />
Hodgkin AL, Huxley AF (1952) A quantitative description of membrane current and ist<br />
application to conduction and excitation in nerve. Journal of Physiology (London) 117:500-<br />
544<br />
Dudel J, Menzel R, Schmitt RF (2001) Neurowissenschaft. Vom Molekül zur Kognition, 2.<br />
Aufl. Springer, Berlin<br />
Koch C (1999) Biophysics of Computation. Information processing in single neurons. Oxford<br />
University Press, New York, Oxford<br />
Die Aufgaben<br />
Im Protokoll sollten Sie:<br />
- eine genaue Beschreibung der Simulation anfertigen<br />
- alle Parameter auflisten <strong>und</strong><br />
- alle benötigten Formeln auflisten <strong>und</strong> gegebenenfalls erklären, warum diese Formeln<br />
benutzt wurden.<br />
Aufgabe 1: Aufbau eines einfachen Netzwerkes.<br />
Hier sollen Sie sich erst einmal anhand eines einfachen Netzwerkes mit dem Programm<br />
vertraut machen.<br />
Öffnen Sie das erste Netzwerk („osc.ntw“) <strong>und</strong> die erste Simulation („osc.smu“).<br />
Analysieren Sie das Netzwerk:<br />
- Beschreiben Sie die Neurone (Leitfähigkeiten) <strong>und</strong> ihre synaptischen Verbindungen.<br />
- Starten Sie die Simulation <strong>und</strong> beschreiben Sie möglichst präzise die Aktivität (Aktionspotentiale,<br />
Verlauf der Membranpotentiale, zeitliche Dynamik der Aktivität) der Neurone.<br />
Machen sie eine Skizze oder einen screenshot, den Sie beschriften. Wodurch wird das<br />
Netzwerk aktiviert?<br />
- Entwickeln Sie eine Hypothese, wodurch das Netzwerk rhythmische Aktivität erzeugen<br />
kann. Wie können Sie Ihre Hypothese verifizieren? Notieren Sie die Ergebnisse Ihrer<br />
Modulationsversuche.<br />
84
- Untersuchen Sie die Ionenströme der Neurone <strong>und</strong> die synaptischen Ströme. Welche<br />
Leitfähigkeiten sind im Modell eingebaut? Unterscheiden sich die Neurone? Welche<br />
Gleichungen liegen der Simulation der Ionenströme zugr<strong>und</strong>e? Welches Modell liegt der<br />
Simulation der Leitfähigkeiten zugr<strong>und</strong>e? Wodurch unterscheiden sich die synaptischen<br />
Verbindungen zwischen den Neuronen? Wie wirken sich Veränderungen von Parametern<br />
auf das Aktivitätsmuster der Neurone <strong>und</strong>/oder den erzeugten Rhythmus des Netzwerkes<br />
aus? Testen Sie einige dieser Parameterveränderungen <strong>und</strong> protokollieren Sie deren<br />
Effekte auf die Netzwerkaktivität.<br />
Aufgabe 2: Erstellung eines autonomen Schwingkreises<br />
In dieser Aufgabe geht es darum, einen Verb<strong>und</strong> aus Standardzellen, der normalerweise<br />
nicht spontan aktiv ist, von selbst zum Schwingen zu bringen. Dieses Phänomen trifft man<br />
zum Beispiel in Mustergeneratoren die <strong>für</strong> die Rhythmik von Lauf- oder Flugbewegungen<br />
zuständig sind (s. o.).<br />
- Fügen Sie dem Netzwerk ein Neuron hinzu. Das neue Neuron sollte auf Depolarisation<br />
Aktionspotentiale generieren. Verändern Sie bei Bedarf seine Eigenschaften dementsprechend<br />
<strong>und</strong> begründen Sie dies.<br />
- Stellen Sie die neue Zelle auch graphisch im Output Screen dar. Wie reagiert Ihr Neuron<br />
auf eine Depolarisation? Machen sie Skizzen/Screenshots <strong>für</strong> Ihr Protokoll.<br />
- Ändern Sie die Eigenschaften Ihres Neurons derart, daß es tonisch aktiv ist, also auch<br />
ohne experimentelle Membrandepolarisation Aktionspotentiale generiert. Welche<br />
Leitfähigkeiten haben Sie hierzu geändert? Beschreiben Sie Ihr Neuron (Ionenströme,<br />
Aktionspotentiale, Frequenz der Aktionspotentiale). Welche Parameter müssen Sie<br />
ändern, um die Aktionspotentialfrequenz Ihres Neurons zu erhöhen / verringern?<br />
- Koppeln Sie Ihr Neuron an das bestehende Netzwerk synaptisch an. Wie gehen Sie<br />
hierzu vor? Welche Optionen haben Sie dazu?<br />
- Ersetzen Sie die Depolarisation eines der Netzwerkneurone, indem Sie Ihre neue Zelle<br />
durch eine exzitatorische synaptische Verbindung an dieses Netzwerkneuron<br />
verschalten. Ist Ihr Netzwerk nun in der Lage einen Rhythmus zu generieren?<br />
Beschreiben Sie die Aktivität Ihres 3-Neuron-Netzwerkes. Ändern Sie gegebenenfalls die<br />
synaptischen Verbindungen zwischen den Neuronen <strong>und</strong> begründen Sie die<br />
Veränderungen der Netzwerkaktivität, die sich hierdurch ergeben.<br />
85
Aufgabe 3: Analyse eines Netzwerkes<br />
Abschließend sollen Sie versuchen, Hypothesen über ein Ihnen unbekanntes Netzwerk<br />
anhand von Ableitungskurven aufzustellen.<br />
Starten Sie die Simulation „osc.smu“ im Ordner Exp3 (<strong>und</strong> NUR die Simulation!). Sie sehen<br />
die Ableitungen von vier Neuronen eines Netzwerkes. Beschreiben Sie dessen Aktivität.<br />
- Stellen Sie anhand der Ergebnisse der Simulation eine Hypothese zur Beschaffenheit<br />
des Netzwerkes (d.h. die Verschaltungen zwischen den Neuronen <strong>und</strong> deren<br />
Aktivitätsmuster) auf <strong>und</strong> überlegen Sie sich einige Experimente um ihre Hypothesen zu<br />
testen. Stellen Sie sich vor, dies wäre ein echtes Experiment <strong>und</strong> keine Simulation.<br />
Folgende Voraussetzungen sind gegeben:<br />
Alle Neurone lassen sich intrazellulär ableiten<br />
Sie können von mehreren Neuronen gleichzeitig ableiten<br />
Sie können die einzelnen Nervenzellen Reizen beliebiger Länge <strong>und</strong> Stärke aussetzen<br />
- Führen sie diese Experimente durch <strong>und</strong> beschreiben Sie ihre Resultate. Läßt sich Ihre<br />
Ausgangshypothese halten? Wenn nicht, überarbeiten sie diese <strong>und</strong> überprüfen sie<br />
durch weitere Experimente.<br />
- Zeichnen Sie anhand Ihrer Versuchsergebnisse ein Schema des Netzwerkes mit allen<br />
Neuronen <strong>und</strong> Synapsen. Markieren Sie, welche Neurone Teil des CPG sind <strong>und</strong> welche<br />
Synapsentypen die Neurone verbinden.<br />
- Lassen Sie sich das Netzwerk des Programms anzeigen <strong>und</strong> vergleichen Sie das<br />
tatsächliche Netzwerk mit dem von Ihnen aufgestellten Netzwerk.<br />
86