GP-Skript für WS 2013/2014 (pdf) - in der Biochemie
GP-Skript für WS 2013/2014 (pdf) - in der Biochemie
GP-Skript für WS 2013/2014 (pdf) - in der Biochemie
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Versuch: Nukle<strong>in</strong>säuren I- Genetischer F<strong>in</strong>gerpr<strong>in</strong>t -<br />
_________________________________________________________________________________________<br />
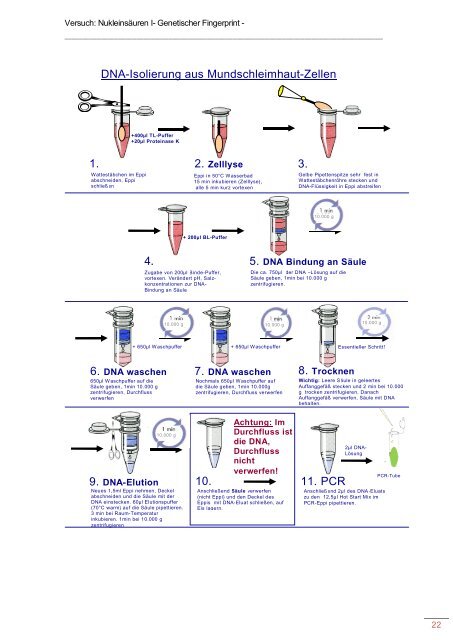
DNA-Isolierung aus Mundschleimhaut-Zellen<br />
(Schema)<br />
+400µl TL-Puffer<br />
+20µl Prote<strong>in</strong>ase K<br />
1.<br />
Wattestäbchen im Eppi<br />
abschneiden, Eppi<br />
schließen<br />
2. Zelllyse<br />
Eppi <strong>in</strong> 50°C Wasserbad<br />
15 m<strong>in</strong> <strong>in</strong>kubieren (Zelllyse),<br />
alle 5 m<strong>in</strong> kurz vortexen<br />
3.<br />
Gelbe Pipettenspitze sehr fest <strong>in</strong><br />
Wattestäbchenröhre stecken und<br />
DNA-Flüssigkeit <strong>in</strong> Eppi abstreifen<br />
10.000 g<br />
+ 200µl BL-Puffer<br />
4. 5. DNA B<strong>in</strong>dung an Säule<br />
Zugabe von 200µl B<strong>in</strong>de-Puffer,<br />
vortexen. Verän<strong>der</strong>t pH, Salzkonzentrationen<br />
zur DNA-<br />
B<strong>in</strong>dung an Säule<br />
Die ca. 750µl <strong>der</strong> DNA –Lösung auf die<br />
Säule geben, 1m<strong>in</strong> bei 10.000 g<br />
zentrifugieren.<br />
10.000 g 10.000 g<br />
10.000 g<br />
+ 650µl Waschpuffer + 650µl Waschpuffer<br />
Essentieller Schritt!<br />
6. DNA waschen 7. DNA waschen 8. Trocknen<br />
650µl Waschpuffer auf die<br />
Säule geben, 1m<strong>in</strong> 10.000 g<br />
zentrifugieren, Durchfluss<br />
verwerfen<br />
Nochmals 650µl Waschpuffer auf<br />
die Säule geben, 1m<strong>in</strong> 10.000g<br />
zentrifugieren, Durchfluss verwerfen<br />
zentrifug.<br />
Wichtig: Leere Säule <strong>in</strong> geleertes<br />
Auffanggefäß stecken und 2 m<strong>in</strong> bei 10.000<br />
g trocken zentrifugieren, Danach<br />
Auffanggefäß verwerfen, Säule mit DNA<br />
behalten.<br />
10.000 g<br />
9. DNA-Elution 10.<br />
DD<br />
Neues 1,5ml Eppi nehmen, Deckel<br />
abschneiden und die Säule mit <strong>der</strong><br />
DNA e<strong>in</strong>stecken. 60µl Elutionspuffer<br />
(70°C warm) auf die Säule pipettieren.<br />
3 m<strong>in</strong> bei Raum-Temperatur<br />
<strong>in</strong>kubieren. 1m<strong>in</strong> bei 10.000 g<br />
zentrifugieren<br />
Achtung: Im<br />
Durchfluss ist<br />
die DNA,<br />
Durchfluss<br />
nicht<br />
verwerfen!<br />
Anschließend Säule verwerfen<br />
(nicht Eppi) und den Deckel des<br />
Eppis mit DNA-Eluat schließen, auf<br />
Eis lagern.<br />
11. PCR<br />
2µl DNA-<br />
Lösung<br />
Anschließend 2µl des DNA-Eluats<br />
zu den 12,5µl Hot Start Mix im<br />
PCR-Eppi pipettieren.<br />
PCR-Tube<br />
22