GIÁO ÁN HÓA HỌC 10 CƠ BẢN NĂM HỌC 2018-2019 (GIÁO VIÊN PHẠM THU HƯƠNG – TRƯỜNG THPT LÊ QUÝ ĐÔN)
https://app.box.com/s/pmzmj6uhj4h3d567hpqs5dbq9v88e9oh
https://app.box.com/s/pmzmj6uhj4h3d567hpqs5dbq9v88e9oh
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
<strong>GIÁO</strong> <strong>ÁN</strong> <strong>HÓA</strong> <strong>HỌC</strong> <strong>10</strong> <strong>CƠ</strong> <strong>BẢN</strong> <strong>NĂM</strong> <strong>HỌC</strong> <strong>2018</strong>-<strong>2019</strong><br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho học sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn <strong>10</strong>00B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
a.Đặt vấn đề: Dẫn dắt từ bài cũ<br />
b.Triển khai bài<br />
MnO 2 , t 0<br />
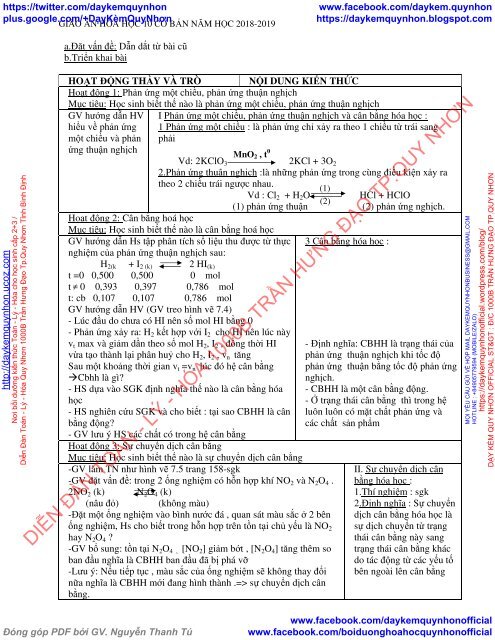
HOẠT ĐỘNG THẦY VÀ TRÒ NỘI DUNG KIẾN THỨC<br />
Hoạt động 1: Phản ứng một chiều, phản ứng thuận nghịch<br />
Mục tiêu: Học sinh biết thế nào là phản ứng một chiều, phản ứng thuận nghịch<br />
GV hướng dẫn HV<br />
hiểu về phản ứng<br />
một chiều và phản<br />
I Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học :<br />
1 Phản ứng một chiều : là phản ứng chỉ xảy ra theo 1 chiều từ trái sang<br />
phải<br />
ứng thuận nghịch<br />
Vd: 2KClO 3 2KCl + 3O 2<br />
2.Phản ứng thuận nghịch :là những phản ứng trong cùng điều kiện xảy ra<br />
theo 2 chiều trái ngược nhau.<br />
(1)<br />
Vd : Cl 2 + H 2 O<br />
HCl + HClO<br />
(2)<br />
(1) phản ứng thuận (2) phản ứng nghịch.<br />
Hoạt động 2: Cân bằng hoá học<br />
Mục tiêu: Học sinh biết thế nào là cân bằng hoá học<br />
GV hướng dẫn Hs tập phân tích số liệu thu được từ thực 3 Cân bằng hóa học :<br />
nghiệm của phản ứng thuận nghịch sau:<br />
H 2(k + I 2 (k) 2 HI (k)<br />
t =0 0,500 0,500 0 mol<br />
t ≠ 0 0,393 0,397 0,786 mol<br />
t: cb 0,<strong>10</strong>7 0,<strong>10</strong>7 0,786 mol<br />
GV hướng dẫn HV (GV treo hình vẽ 7.4)<br />
- Lúc đầu do chưa có HI nên số mol HI bằng 0<br />
- Phản ứng xảy ra: H 2 kết hợp với I 2 cho HI nên lúc này<br />
v t max và giảm dần theo số mol H 2 , I 2 , đồng thời HI<br />
vừa tạo thành lại phân huỷ cho H 2 , I 2 , v n tăng<br />
Sau một khoảng thời gian v t =v n lúc đó hệ cân bằng<br />
Cbhh là gì?<br />
- HS dựa vào SGK định nghĩa thế nào là cân bằng hóa<br />
học<br />
- HS nghiên cứu SGK và cho biết : tại sao CBHH là cân<br />
bằng động?<br />
- Định nghĩa: CBHH là trạng thái của<br />
phản ứng thuận nghịch khi tốc độ<br />
phản ứng thuận bằng tốc độ phản ứng<br />
nghịch.<br />
- CBHH là một cân bằng động.<br />
- Ở trạng thái cân bằng thì trong hệ<br />
luôn luôn có mặt chất phản ứng và<br />
các chất sản phẩm<br />
- GV lưu ý HS các chất có trong hệ cân bằng<br />
Hoạt động 3: Sự chuyển dịch cân bằng<br />
Mục tiêu: Học sinh biết thế nào là sự chuyển dịch cân bằng<br />
-GV làm TN như hình vẽ 7.5 trang 158-sgk<br />
-GV đặt vấn đề: trong 2 ống nghiệm có hỗn hợp khí NO 2 và N 2 O 4 .<br />
II. Sự chuyển dịch cân<br />
bằng hóa học :<br />
2NO 2 (k) N 2 O 4 (k)<br />
1.Thí nghiệm : sgk<br />
(nâu đỏ) (không màu)<br />
2.Định nghĩa : Sự chuyển<br />
-Đặt một ống nghiệm vào bình nước đá , quan sát màu sắc ở 2 bên<br />
ống nghiệm, Hs cho biết trong hỗn hợp trên tồn tại chủ yếu là NO 2<br />
hay N 2 O 4 ?<br />
-GV bổ sung: tồn tại N 2 O 4 , [NO 2 ] giảm bớt , [N 2 O 4 ] tăng thêm so<br />
ban đầu nghĩa là CBHH ban đầu đã bị phá vỡ<br />
-Lưu ý: Nếu tiếp tục , màu sắc của ống nghiệm sẽ không thay đổi<br />
dịch cân bằng hóa học là<br />
sự dịch chuyển từ trạng<br />
thái cân bằng này sang<br />
trạng thái cân bằng khác<br />
do tác động từ các yếu tố<br />
bên ngoài lên cân bằng<br />
nữa nghĩa là CBHH mới đang hình thành .=> sự chuyển dịch cân<br />
bằng.<br />
DIỄN ĐÀN TO<strong>ÁN</strong> - LÝ - <strong>HÓA</strong> <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C <strong>10</strong>00B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial