Guia de quimica I - Cecyte
Guia de quimica I - Cecyte
Guia de quimica I - Cecyte
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
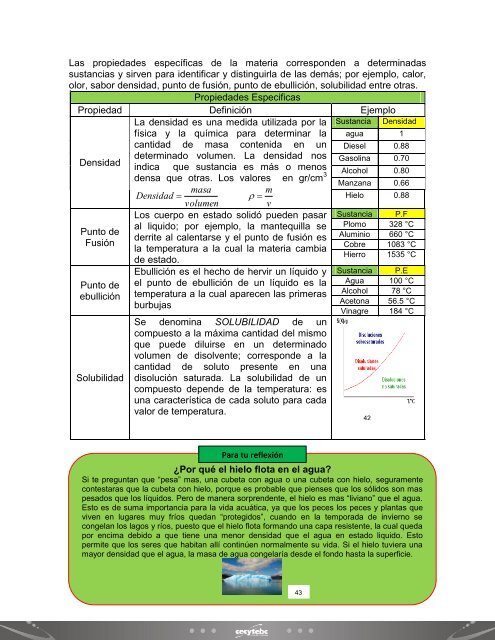
Las propieda<strong>de</strong>s específicas <strong>de</strong> la materia correspon<strong>de</strong>n a <strong>de</strong>terminadas<br />
sustancias y sirven para i<strong>de</strong>ntificar y distinguirla <strong>de</strong> las <strong>de</strong>más; por ejemplo, calor,<br />
olor, sabor <strong>de</strong>nsidad, punto <strong>de</strong> fusión, punto <strong>de</strong> ebullición, solubilidad entre otras.<br />
Propieda<strong>de</strong>s Especificas<br />
Propiedad Definición Ejemplo<br />
La <strong>de</strong>nsidad es una medida utilizada por la<br />
física y la química para <strong>de</strong>terminar la<br />
cantidad <strong>de</strong> masa contenida en un<br />
Densidad<br />
<strong>de</strong>terminado volumen. La <strong>de</strong>nsidad nos<br />
indica que sustancia es más o menos<br />
<strong>de</strong>nsa que otras. Los valores en gr/cm 3<br />
Sustancia Densidad<br />
agua 1<br />
Diesel 0.88<br />
masa<br />
m<br />
Densidad <br />
<br />
volumen v<br />
Gasolina<br />
Alcohol<br />
Manzana<br />
Hielo<br />
0.70<br />
0.80<br />
0.66<br />
0.88<br />
Los cuerpo en estado solidó pue<strong>de</strong>n pasar Sustancia P.F<br />
Punto <strong>de</strong><br />
Fusión<br />
al liquido; por ejemplo, la mantequilla se<br />
<strong>de</strong>rrite al calentarse y el punto <strong>de</strong> fusión es<br />
la temperatura a la cual la materia cambia<br />
<strong>de</strong> estado.<br />
Ebullición es el hecho <strong>de</strong> hervir un líquido y<br />
Plomo<br />
Aluminio<br />
Cobre<br />
Hierro<br />
328 °C<br />
660 °C<br />
1083 °C<br />
1535 °C<br />
Punto <strong>de</strong><br />
ebullición<br />
el punto <strong>de</strong> ebullición <strong>de</strong> un líquido es la<br />
temperatura a la cual aparecen las primeras<br />
burbujas<br />
Solubilidad<br />
Se <strong>de</strong>nomina SOLUBILIDAD <strong>de</strong> un<br />
compuesto a la máxima cantidad <strong>de</strong>l mismo<br />
que pue<strong>de</strong> diluirse en un <strong>de</strong>terminado<br />
volumen <strong>de</strong> disolvente; correspon<strong>de</strong> a la<br />
cantidad <strong>de</strong> soluto presente en una<br />
disolución saturada. La solubilidad <strong>de</strong> un<br />
compuesto <strong>de</strong>pen<strong>de</strong> <strong>de</strong> la temperatura: es<br />
una característica <strong>de</strong> cada soluto para cada<br />
valor <strong>de</strong> temperatura.<br />
Para tu reflexión<br />
Sustancia P.E<br />
Agua 100 °C<br />
Alcohol 78 °C<br />
Acetona 56.5 °C<br />
Vinagre 184 °C<br />
¿Por qué el hielo flota en el agua?<br />
Si te preguntan que “pesa” mas, una cubeta con agua o una cubeta con hielo, seguramente<br />
contestaras que la cubeta con hielo, porque es probable que pienses que los sólidos son mas<br />
pesados que los líquidos. Pero <strong>de</strong> manera sorpren<strong>de</strong>nte, el hielo es mas “liviano” que el agua.<br />
Esto es <strong>de</strong> suma importancia para la vida acuática, ya que los peces los peces y plantas que<br />
viven en lugares muy fríos quedan “protegidos”, cuando en la temporada <strong>de</strong> invierno se<br />
congelan los lagos y ríos, puesto que el hielo flota formando una capa resistente, la cual queda<br />
por encima <strong>de</strong>bido a que tiene una menor <strong>de</strong>nsidad que el agua en estado liquido. Esto<br />
permite que los seres que habitan allí continúen normalmente su vida. Si el hielo tuviera una<br />
mayor <strong>de</strong>nsidad que el agua, la masa <strong>de</strong> agua congelaría <strong>de</strong>s<strong>de</strong> el fondo hasta la superficie.<br />
43<br />
42<br />
40