PDF Download - Laborwelt
PDF Download - Laborwelt
PDF Download - Laborwelt
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Die Auswahl der Lichtquelle ist ein Beispiel<br />
für die Kompromisse bei der Konstruktion der<br />
Fluoreszenzdetektoren. Bei dem Standard-<br />
Fluoreszenz-Detektor wird ein Bereich von 190<br />
bis 900 nm abgedeckt, wobei bei der Messung<br />
ein Bereich von ± 10 nm um die gewünschte<br />
Anregungswellenlänge relevant ist. Der Rest<br />
der Lampenenergie wird verschwendet und<br />
kann durch entstehende Wärmeenergie zur<br />
Dekomposition der Probe führen. Bei der Laser-induzierten<br />
Fluoreszenz wird der Laser<br />
speziell auf die Applikation und die dabei benötigte<br />
Wellenlänge hin ausgewählt. Mit Hilfe<br />
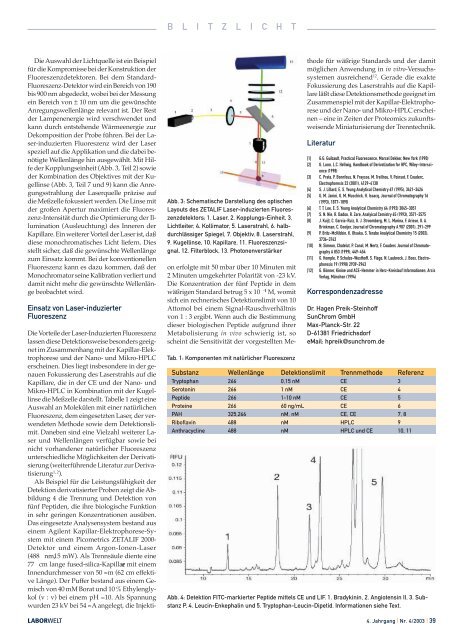
der Kopplungseinheit (Abb. 3, Teil 2) sowie<br />
der Kombination des Objektives mit der Kugellinse<br />
(Abb. 3, Teil 7 und 9) kann die Anregungsstrahlung<br />
der Laserquelle präzise auf<br />
die Meßzelle fokussiert werden. Die Linse mit<br />
der großen Apertur maximiert die Fluoreszenz-Intensität<br />
durch die Optimierung der Illumination<br />
(Ausleuchtung) des Inneren der<br />
Kapillare. Ein weiterer Vorteil der Laser ist, daß<br />
diese monochromatisches Licht liefern. Dies<br />
stellt sicher, daß die gewünschte Wellenlänge<br />
zum Einsatz kommt. Bei der konventionellen<br />
Fluoreszenz kann es dazu kommen, daß der<br />
Monochromator seine Kalibration verliert und<br />
damit nicht mehr die gewünschte Wellenlänge<br />
beobachtet wird.<br />
Einsatz von Laser-induzierter<br />
Fluoreszenz<br />
Die Vorteile der Laser-Induzierten Fluoreszenz<br />
lassen diese Detektionsweise besonders geeignet<br />
im Zusammenhang mit der Kapillar-Elektrophorese<br />
und der Nano- und Mikro-HPLC<br />
erscheinen. Dies liegt insbesondere in der genauen<br />
Fokussierung des Laserstrahls auf die<br />
Kapillare, die in der CE und der Nano- und<br />
Mikro-HPLC in Kombination mit der Kugellinse<br />
die Meßzelle darstellt. Tabelle 1 zeigt eine<br />
Auswahl an Molekülen mit einer natürlichen<br />
Fluoreszenz, dem eingesetzten Laser, der verwendeten<br />
Methode sowie dem Detektionslimit.<br />
Daneben sind eine Vielzahl weiterer Laser<br />
und Wellenlängen verfügbar sowie bei<br />
nicht vorhandener natürlicher Fluoreszenz<br />
unterschiedliche Möglichkeiten der Derivatisierung<br />
(weiterführende Literatur zur Derivatisierung1,<br />
2 ).<br />
Als Beispiel für die Leistungsfähigkeit der<br />
Detektion derivatisierter Proben zeigt die Abbildung<br />
4 die Trennung und Detektion von<br />
fünf Peptiden, die ihre biologische Funktion<br />
in sehr geringen Konzentrationen ausüben.<br />
Das eingesetzte Analysensystem bestand aus<br />
einem Agilent Kapillar-Elektrophorese-System<br />
mit einem Picometrics ZETALIF 2000-<br />
Detektor und einem Argon-Ionen-Laser<br />
(488 nm, 15 mW). Als Trennsäule diente eine<br />
77 cm lange fused-silica-Kapillare mit einem<br />
Innendurchmesser von 50 µm (62 cm effektive<br />
Länge). Der Puffer bestand aus einem Gemisch<br />
von 40 mM Borat und 10 % Ethylenglykol<br />
(v : v) bei einem pH =10. Als Spannung<br />
wurden 23 kV bei 54 µA angelegt, die Injekti-<br />
B L I T Z L I C H T<br />
Abb. 3: Schematische Darstellung des optischen<br />
Layouts des ZETALIF Laser-induzierten Fluoreszenzdetektors:<br />
1. Laser, 2. Kopplungs-Einheit, 3.<br />
Lichtleiter, 4. Kollimator, 5. Laserstrahl, 6. halbdurchlässiger<br />
Spiegel, 7. Objektiv, 8. Laserstrahl,<br />
9. Kugellinse, 10. Kapillare, 11. Fluoreszenzsignal,<br />
12. Filterblock, 13. Photonenverstärker<br />
on erfolgte mit 50 mbar über 10 Minuten mit<br />
2 Minuten umgekehrter Polarität von -23 kV.<br />
Die Konzentration der fünf Peptide in dem<br />
wäßrigen Standard betrug 5 x 10 –1 M, womit<br />
sich ein rechnerisches Detektionslimit von 10<br />
Attomol bei einem Signal-Rauschverhältnis<br />
von 1 : 3 ergibt. Wenn auch die Bestimmung<br />
dieser biologischen Peptide aufgrund ihrer<br />
Metabolisierung in vivo schwierig ist, so<br />
scheint die Sensitivität der vorgestellten Me-<br />
Tab. 1: Komponenten mit natürlicher Fluoreszenz<br />
thode für wäßrige Standards und der damit<br />
möglichen Anwendung in in vitro-Versuchssystemen<br />
ausreichend 12 . Gerade die exakte<br />
Fokussierung des Laserstrahls auf die Kapillare<br />
läßt diese Detektionsmethode geeignet im<br />
Zusammenspiel mit der Kapillar-Elektrophorese<br />
und der Nano- und Mikro-HPLC erscheinen<br />
– eine in Zeiten der Proteomics zukunftsweisende<br />
Miniaturisierung der Trenntechnik.<br />
Literatur<br />
[1] G.G. Guibault, Practical Fluorescence, Marcel Dekker, New York (1990)<br />
[2] G. Lunn, L.C. Hellwig, Handbook of Derivatization for HPC, Wiley-Interscience<br />
(1998)<br />
[3] C. Prata, P. Bonnfous, N. Fraysse, M. Treilhou, V. Poinsot, F. Couderc,<br />
Electrophoresis 22 (2001), 4129-4138<br />
[4] S. J. Lillard, E. S. Yeung Analytical Chemistry 67 (1995), 3421-3426<br />
[5] G. M. Janini, G. M. Muschick, H. Issacq, Journal of Chromatography 16<br />
(1993), 1877-1890<br />
[6] T. T. Lee, E. S. Yeung Analytical Chemistry 64 (1992) 3045-3051<br />
[7] S. N. Nie, R. Dadoo, R. Zare, Analyical Cemistry 65 (1993), 3571-3575<br />
[8] J. Kuijt, C. Garcia-Ruiz, G. J. Stroomberg, M. L. Marina, F. Ariese, U. A.<br />
Brinkman, C. Gooijer, Journal of Chromatography A 907 (2001), 291-299<br />
[9] P. Britz-McKibbin, K. Otsuka, S. Terabe Analytical Chemistry 15 (2002),<br />
3736-3743<br />
[10] N. Simeon, Chatelut, P. Canal, M. Nertz, F. Couderc Journal of Chromatography<br />
A 853 (1999), 449-454<br />
[11] G. Hemple, P. Schulze-Westhoff, S. Flege, N. Laubrock, J. Boos, Electrophoresis<br />
19 (1998) 2939-2943<br />
[12] G. Bönner, Kinine und ACE-Hemmer in Herz-Kreislauf Informationen, Arcis<br />
Verlag, München (1994)<br />
Korrespondenzadresse<br />
Dr. Hagen Preik-Steinhoff<br />
SunChrom GmbH<br />
Max-Planck-Str. 22<br />
D-61381 Friedrichsdorf<br />
eMail: hpreik@sunchrom.de<br />
Substanz Wellenlänge Detektionslimit Trennmethode Referenz<br />
Tryptophan 266 0,15 nM CE 3<br />
Serotonin 266 1 nM CE 4<br />
Peptide 266 1-10 nM CE 5<br />
Proteine 266 60 ng/mL CE 6<br />
PAH 325,266 nM, nM CE, CE 7, 8<br />
Riboflavin 488 nM HPLC 9<br />
Anthracycline 488 nM HPLC und CE 10, 11<br />
Abb. 4: Detektion FITC-markierter Peptide mittels CE und LIF. 1. Bradykinin, 2. Angiotensin II, 3. Substanz<br />
P, 4. Leucin-Enkephalin und 5. Tryptophan-Leucin-Dipetid. Informationen siehe Text.<br />
LABORWELT 4. Jahrgang | Nr. 4/2003 | 39