Die Untersuchung des immunoliposomalen Targetings von ...
Die Untersuchung des immunoliposomalen Targetings von ...
Die Untersuchung des immunoliposomalen Targetings von ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
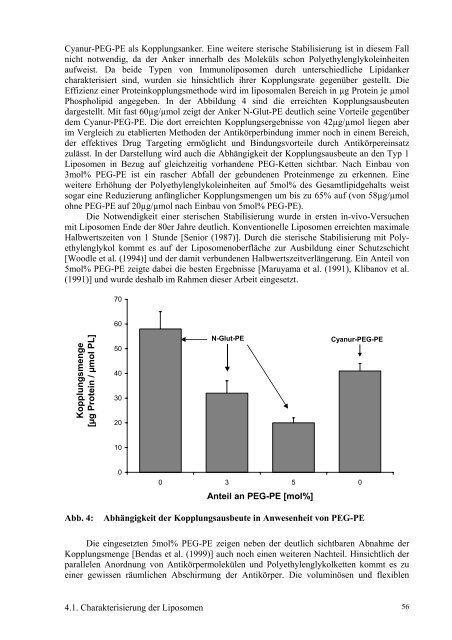
Cyanur-PEG-PE als Kopplungsanker. Eine weitere sterische Stabilisierung ist in diesem Fall<br />
nicht notwendig, da der Anker innerhalb <strong>des</strong> Moleküls schon Polyethylenglykoleinheiten<br />
aufweist. Da beide Typen <strong>von</strong> Immunoliposomen durch unterschiedliche Lipidanker<br />
charakterisiert sind, wurden sie hinsichtlich ihrer Kopplungsrate gegenüber gestellt. <strong>Die</strong><br />
Effizienz einer Proteinkopplungsmethode wird im liposomalen Bereich in µg Protein je µmol<br />
Phospholipid angegeben. In der Abbildung 4 sind die erreichten Kopplungsausbeuten<br />
dargestellt. Mit fast 60µg/µmol zeigt der Anker N-Glut-PE deutlich seine Vorteile gegenüber<br />
dem Cyanur-PEG-PE. <strong>Die</strong> dort erreichten Kopplungsergebnisse <strong>von</strong> 42µg/µmol liegen aber<br />
im Vergleich zu etablierten Methoden der Antikörperbindung immer noch in einem Bereich,<br />
der effektives Drug Targeting ermöglicht und Bindungsvorteile durch Antikörpereinsatz<br />
zulässt. In der Darstellung wird auch die Abhängigkeit der Kopplungsausbeute an den Typ 1<br />
Liposomen in Bezug auf gleichzeitig vorhandene PEG-Ketten sichtbar. Nach Einbau <strong>von</strong><br />
3mol% PEG-PE ist ein rascher Abfall der gebundenen Proteinmenge zu erkennen. Eine<br />
weitere Erhöhung der Polyethylenglykoleinheiten auf 5mol% <strong>des</strong> Gesamtlipidgehalts weist<br />
sogar eine Reduzierung anfänglicher Kopplungsmengen um bis zu 65% auf (<strong>von</strong> 58µg/µmol<br />
ohne PEG-PE auf 20µg/µmol nach Einbau <strong>von</strong> 5mol% PEG-PE).<br />
<strong>Die</strong> Notwendigkeit einer sterischen Stabilisierung wurde in ersten in-vivo-Versuchen<br />
mit Liposomen Ende der 80er Jahre deutlich. Konventionelle Liposomen erreichten maximale<br />
Halbwertszeiten <strong>von</strong> 1 Stunde [Senior (1987)]. Durch die sterische Stabilisierung mit Polyethylenglykol<br />
kommt es auf der Liposomenoberfläche zur Ausbildung einer Schutzschicht<br />
[Woodle et al. (1994)] und der damit verbundenen Halbwertszeitverlängerung. Ein Anteil <strong>von</strong><br />
5mol% PEG-PE zeigte dabei die besten Ergebnisse [Maruyama et al. (1991), Klibanov et al.<br />
(1991)] und wurde <strong>des</strong>halb im Rahmen dieser Arbeit eingesetzt.<br />
Kopplungsmenge<br />
[µg Protein / µmol PL]<br />
70<br />
60<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
N-Glut-PE Cyanur-PEG-PE<br />
0 3 5 0<br />
Anteil an PEG-PE [mol%]<br />
Abb. 4: Abhängigkeit der Kopplungsausbeute in Anwesenheit <strong>von</strong> PEG-PE<br />
<strong>Die</strong> eingesetzten 5mol% PEG-PE zeigen neben der deutlich sichtbaren Abnahme der<br />
Kopplungsmenge [Bendas et al. (1999)] auch noch einen weiteren Nachteil. Hinsichtlich der<br />
parallelen Anordnung <strong>von</strong> Antikörpermolekülen und Polyethylenglykolketten kommt es zu<br />
einer gewissen räumlichen Abschirmung der Antikörper. <strong>Die</strong> voluminösen und flexiblen<br />
4.1. Charakterisierung der Liposomen<br />
56