Oo - Universidad Complutense de Madrid
Oo - Universidad Complutense de Madrid
Oo - Universidad Complutense de Madrid
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
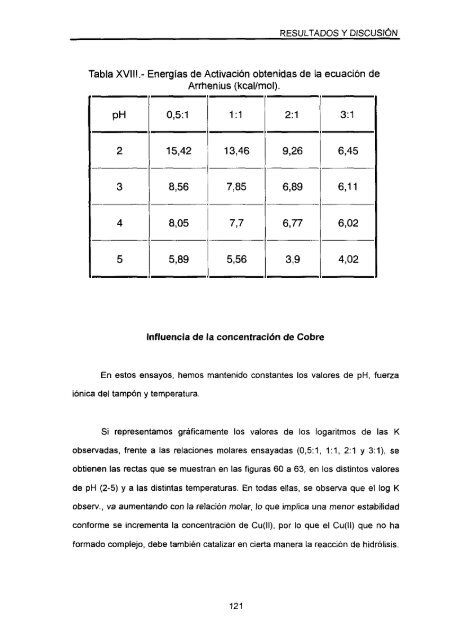
Tabla XVLII.-Energías <strong>de</strong> Activación obtenidas <strong>de</strong><br />
Arrhenius (kcal/mol).<br />
RESULTADOS Y DISCUSIÓN<br />
La ecuac¡ón <strong>de</strong><br />
pH 0,5:1 1:1 2:1 3:1<br />
2 15,42 13,46 9,26 6,45<br />
3 8,56 7,85 6,89 6,11<br />
4 8,05 7,7 6,77 6,02<br />
5 5,89 5,56 3,9 4,02<br />
Influencia <strong>de</strong> la concentración <strong>de</strong> Cobre<br />
En estos ensayos, hemos mantenido constantes los valores <strong>de</strong> pH, fuerza<br />
iónica <strong>de</strong>l tampón y temperatura.<br />
Si representamos gráficamente los valores <strong>de</strong> los logaritmos <strong>de</strong> las K<br />
observadas, frente a las relaciones molares ensayadas (0,5:1, 1:1, 2:1 y 3:1), se<br />
obtienen las rectas que se muestran en las figuras 60 a 63, en los distintos valores<br />
<strong>de</strong> pH (2-5) y a las distintas temperaturas. En todas ellas, se observa que el log K<br />
observ., va aumentando con la relación molar, lo que implica una menor estabilidad<br />
conforme se incrementa la concentración <strong>de</strong> Cu(ll), por lo que el Cu(lI) que no ha<br />
formado complejo, <strong>de</strong>be también catalizar en cierta manera la reacción <strong>de</strong> hidrólisis.<br />
121