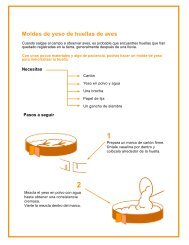
Ciencias M+¦dulo 2 Qu+¡mica Estudiantes.pdf - Educarchile
Ciencias M+¦dulo 2 Qu+¡mica Estudiantes.pdf - Educarchile
Ciencias M+¦dulo 2 Qu+¡mica Estudiantes.pdf - Educarchile
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
El agua pesada actúa como un veneno para los organismos superiores, porque<br />
muchos de los procesos bioquímicos son retardados debido a que la masa del<br />
2 H es aproximadamente el doble de la del hidrógeno común o protio, 1 H.<br />
(2) Este principio se suele nombrar también como principio de incerteza o de<br />
incertidumbre.<br />
(3) Un orbital representa una región en la cual se calcula, en cada uno de sus<br />
puntos, la probabilidad de encontrar un electrón. Los orbitales constituyen<br />
funciones matemáticas que son soluciones de la ecuación de Schrödinger y que<br />
están asociadas a los niveles y subniveles de energía.<br />
(4) Hay otras formas de enunciar el principio de exclusión de Pauli, pero esta<br />
es una de las más simples y apropiadas.<br />
(5) Los electrones de niveles internos tienen poca influencia sobre las<br />
propiedades químicas de los átomos.<br />
(6) Hasta hace pocos años se hablaba de “peso atómico”, pero actualmente se<br />
usa el término correcto de masa atómica.<br />
(7) El caso del hidrógeno es único: su configuración electrónica es<br />
simplemente 1s 1 y no hay más que un electrón y un protón nuclear, no<br />
obstante también existen isótopos con 1 neutrón y 2 neutrones. En razón de<br />
ello, el hidrógeno es un elemento muy particular y tiene propiedades que<br />
ningún otro elemento exhibe, aunque su comportamiento es en general similar<br />
al de los no metales.<br />
(8) Esta configuración electrónica es completamente equivalente a cualquiera<br />
de las otras dos posibles 1s 2 2s 2 2px 1 2py 2 2pz 1 o bien, 1s 2 2s 2 2px 1 2py 1 2pz 2 , lo<br />
importante es que en la capa de valencia hay dos electrones desapareados.<br />
Esta configuración electrónica es totalmente equivalente a las configuraciones<br />
1s 2 2s 2 (2px) 2py 1 2pz 1 y 1s 2 2s 2 2px 1 (2py) 2pz 1 . La teoría no especifica en cuál<br />
orbital se hallan los electrones, solo indica que hay dos orbitales “2p”<br />
ocupados, cada uno con un electrón.<br />
41