Revista Piña de Costa Rica Edición 41
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
El cloro es el producto más utilizado<br />
para la <strong>de</strong>sinfección <strong>de</strong> piña. Este elemento<br />
químico es también utilizado en<br />
hogares y otras industrias.<br />
Por ser un producto tan popular, creemos<br />
usarlo bien, pero la realidad es<br />
que la química <strong>de</strong>l cloro es poco conocida<br />
y pue<strong>de</strong> hacer la diferencia entre<br />
obtener el máximo rendimiento y los<br />
mejores resultados a nivel microbiológico.<br />
Regular el pH <strong>de</strong>l agua, garantiza la<br />
<strong>de</strong>sinfección efectiva<br />
El cloro es ampliamente usado como<br />
método <strong>de</strong> <strong>de</strong>sinfección <strong>de</strong> la piña<br />
por su <strong>de</strong>sempeño y costo, pero dicha<br />
condición está <strong>de</strong>terminada por el pH<br />
<strong>de</strong>l agua. Si el pH <strong>de</strong>l agua no se encuentra<br />
<strong>de</strong>ntro <strong>de</strong> un rango favorable,<br />
po<strong>de</strong>mos llegar a utilizar gran<strong>de</strong>s cantida<strong>de</strong>s<br />
<strong>de</strong> producto, para alcanzar un<br />
resultado que pue<strong>de</strong> ser <strong>de</strong>ficiente.<br />
Cuando el hipoclorito <strong>de</strong> sodio entra<br />
en solución con el agua, este se disocia<br />
en dos compuestos: El ácido hipocloroso<br />
(HOCl) y el ion clorito (OCl-). El<br />
ácido hipocloroso tiene una alta capacidad<br />
<strong>de</strong> <strong>de</strong>sinfección, mientras que el<br />
ion clorito posee una muy baja.<br />
Es preferible contar con una alta cantidad<br />
<strong>de</strong> ácido hipocloroso, para lograr<br />
mejores resultados y con una menor inversión.<br />
Un escenario i<strong>de</strong>al sería que<br />
todo el hipoclorito se transformara en<br />
ácido hipocloroso.<br />
Para controlar cuanto ácido hipocloroso<br />
obtengo, <strong>de</strong>bo controlar el pH <strong>de</strong>l<br />
agua.<br />
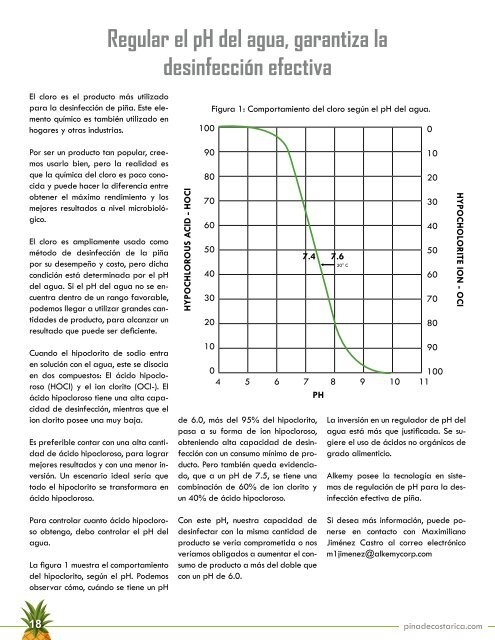
La figura 1 muestra el comportamiento<br />
<strong>de</strong>l hipoclorito, según el pH. Po<strong>de</strong>mos<br />
observar cómo, cuándo se tiene un pH<br />
<strong>de</strong> 6.0, más <strong>de</strong>l 95% <strong>de</strong>l hipoclorito,<br />
pasa a su forma <strong>de</strong> ion hipocloroso,<br />
obteniendo alta capacidad <strong>de</strong> <strong>de</strong>sinfección<br />
con un consumo mínimo <strong>de</strong> producto.<br />
Pero también queda evi<strong>de</strong>nciado,<br />
que a un pH <strong>de</strong> 7.5, se tiene una<br />
combinación <strong>de</strong> 60% <strong>de</strong> ion clorito y<br />
un 40% <strong>de</strong> ácido hipocloroso.<br />
Con este pH, nuestra capacidad <strong>de</strong><br />
<strong>de</strong>sinfectar con la misma cantidad <strong>de</strong><br />
producto se vería comprometida o nos<br />
veríamos obligados a aumentar el consumo<br />
<strong>de</strong> producto a más <strong>de</strong>l doble que<br />
con un pH <strong>de</strong> 6.0.<br />
20° C<br />
La inversión en un regulador <strong>de</strong> pH <strong>de</strong>l<br />
agua está más que justificada. Se sugiere<br />
el uso <strong>de</strong> ácidos no orgánicos <strong>de</strong><br />
grado alimenticio.<br />
Alkemy posee la tecnología en sistemas<br />
<strong>de</strong> regulación <strong>de</strong> pH para la <strong>de</strong>sinfección<br />
efectiva <strong>de</strong> piña.<br />
Si <strong>de</strong>sea más información, pue<strong>de</strong> ponerse<br />
en contacto con Maximiliano<br />
Jiménez Castro al correo electrónico<br />
m1jimenez@alkemycorp.com<br />
18