Jahresbericht 1990 - Eawag-Empa Library
Jahresbericht 1990 - Eawag-Empa Library
Jahresbericht 1990 - Eawag-Empa Library
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
60<br />
4-50<br />
tiges Eisen an der OberfläChe der festen Phase. Diese zweiwertige Eisen ist labiler als das dreiwertige und<br />
wird in die wässrige Lösung abgegeben.<br />
Es wurde der Einfluss des Schwefelwasserstoffs (oder des Hydrogensulfidions) auf die Auflösung von<br />
Hämatit (Fe2O3) untersucht. Die Bedingungen wurden so gewählt, dass das Löslichkeitsprodukt von FeS<br />
nicht überschritten wird.<br />
Das experimentelle System besteht darin, dass eine Suspension von Hämatit einem konstanten Partialdruck<br />
von Schwefelwasserstoff bei konstantem pH (pH-Stat) ausgesetzt, und der FortsChritt der Reaktion<br />
anhand der Konzentration von gelöstem zweiwertigem Eisen und der zugegebenen Säure (pH-Stat) verfolgt<br />
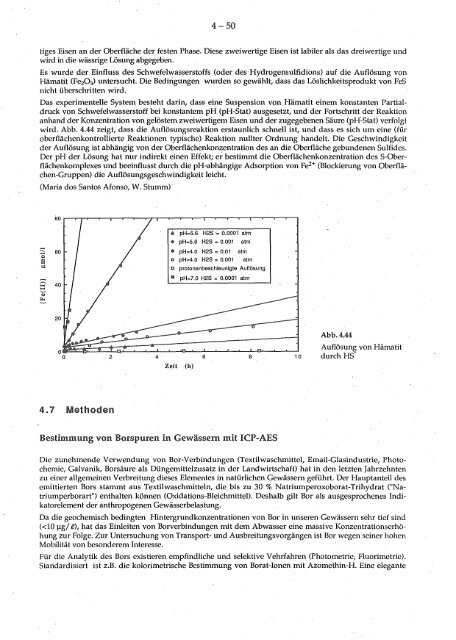
wird. Abb. 4.44 zeigt, dass die Auflösungsreaktion erstaunlich schnell ist, und dass es sich um eine (für<br />
oberflächenkontrollierte Reaktionen typische) Reaktion nullter Ordnung handelt. Die Geschwindigkeit<br />
der Auflösung ist abhängig von der Oberflächenkonzentration des an die Oberfläche gebundenen Sulfides.<br />
Der pH der Lösung hat nur indirekt einen Effekt; er bestimmt die Oberflächenkonzentration des S-OberfläChenkomplexes<br />
und beeinflusst durch die pH-abhängige Adsorption von Fe e+ (BloCkierung von Oberflächen-Gruppen)<br />
die Auflösungsgeschwindigkeit leicht.<br />
(Maria dos Santos Afonso, W. Stumm)<br />
4.7 Mothot9on<br />
• pH=5.6 H2S 0.0001 atm<br />
• pH=5.6 H2S = 0.001 atm<br />
• pH=4.0 H2S = 0.01 atm<br />
o pH=4.0 H2S = 0.001 atm<br />
o protonenbeschleunigte Auflösung<br />
• pH=7.0 H2S 0.0001 atm<br />
Abb. 4.44<br />
Auflösung von Hämatit<br />
4 6 s 1 o durch HS<br />
Zeit (h)<br />
Bestimmung von Borspuren in Gewässern mit ICP-AES<br />
Die zunehmende Verwendung von Bor-Verbindungen (TextilwasChmittel, Email-Glasindustrie, Photochemie,<br />
Galvanik, Borsäure als Düngemittelzusatz in der Landwirtschaft) hat in den letzten Jahrzehnten<br />
zu einer allgemeinen Verbreitung dieses Elementes in natürlichen Gewässern geführt. Der Hauptanteil des<br />
emittierten Bors stammt aus TextilwasChmitteln, die bis zu 30 % Natriumperoxoborat-Trihydrat ("Natriumperborart")<br />
enthalten können (Oxidations-Bleichmittel). Deshalb gilt Bor als ausgesprochenes Indikatorelement<br />
der anthropogenen Gewässerbelastung.<br />
Da die geochemisch bedingten Hintergrundkonzentrationen von Bor in unseren Gewässern sehr tief sind<br />
(