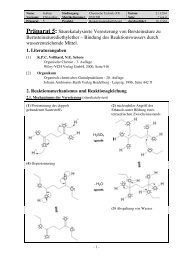
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Gruppe3: Name entfernt, Name entfernt, Christopher Gallian, Name entfernt Versuch T3<br />
Studiengang: Chemische Technik Datum: 07.04.09<br />
Thema: <strong>Bestimmung</strong> <strong>von</strong> <strong>Acetylsalicylsäure</strong> in Schmerzmitteln Seite: 18 <strong>von</strong> 41<br />
4. Konduktometrische <strong>Bestimmung</strong><br />
4.1. Grundlagen der Konduktometrie<br />
Elektrolytlösungen, also Lösungen, die frei bewegliche Ionen enthalten, leiten<br />
den elektrischen Strom. Die Ionen wandern dabei zu den jeweils<br />
entgegengesetzt geladenen Elektroden. Hierbei setzten verschiedene<br />
Elektrolyte dem Stromfluss verschieden große Widerstände entgegen, es gilt<br />
das gleiche Gesetz wie bei metallischen Leitern<br />
Der Kehrwert des elektrischen Widerstandes heißt elektrische Leitfähigkeit κ.<br />
„Bei konduktometrischen <strong>Bestimmung</strong> wird der elektrische Leitwert G (bzw. der<br />
Widerstand R) <strong>von</strong> Elektrolytlösungen gemessen. Die Messung erfolgt mit<br />
Wechselspannung.“ 1 Gleichspannung könnte zur Zersetzung der Lösung durch<br />
Abscheidungen auf den Elektroden und damit zur Polarisation der Elektroden<br />
führen. Bei Wechselspannung findet jedoch Ionentransport ohne Entladung<br />
statt. Die Messung selbst erfolgt stromlos. „Das Produkt aus Leitwert G und<br />
Zellkonstante ergibt die Leitfähigkeit des Elektrolyten (Gleichung 1)<br />
• κ = Leitfähigkeit<br />
• G = Leitwert = 1/R<br />
• R = elektrischer Widerstand [ Ω ]<br />
• k = Zellkonstante der verwendeten Messelektrode“ 1<br />
Die Zellkonstante k ist der Quotient aus Elektrodenabstand l und Elektrodenfläche<br />
A. In der Praxis ist der Widerstand relativ leicht bestimmbar, der<br />
Elektrodenabstand und die Elektrodenfläche jedoch nicht. Deshalb werden sie<br />
zu einem für die jeweilige Leitfähigkeitsmesszelle konstanten Faktor k<br />
zusammengefasst, dieser Wert wird vom Hersteller angegeben. „Die<br />
Leitfähigkeitsmessung ist nicht stoffspezifisch, da alle in einer Lösung<br />
vorliegenden Ladungsträger (Ionen) ihren Beitrag zur Leitfähigkeit leisten.<br />
Deren Beitrag zur Leitfähigkeit ist abhängig <strong>von</strong> Art (Ionenbeweglichkeit) und<br />
Konzentration der vorhandenen Ionen. Über weite Konzentrationsbereiche<br />
herrscht eine lineare Abhängigkeit zwischen Ionenkonzentration und<br />
Leitfähigkeit der Lösung. Da die Ionenbeweglichkeit sehr stark<br />
temperaturabhängig ist, ist auch die Leitfähigkeit eine stark temperaturabhängige<br />
Größe.<br />
Einige typische Anwendungsbereiche konduktometrischer Messungen sind:<br />
• Reinheitskontrolle <strong>von</strong> Lösungen, z.B. Wasser aus Ionenaustauschern<br />
(ention. Wasser)<br />
• Konzentrationsbestimmung <strong>von</strong> einzelnen, dissoziierenden Substanz,<br />
z.B. Säuren, Laugen, Salze<br />
• <strong>Bestimmung</strong> charakteristischer Stoffgrößen, z.B. Löslichkeitskonstante,<br />
Dissoziationsgrad<br />
1 http://www.lrz-muenchen.de/~aae/aaeframe.html<br />
(1)