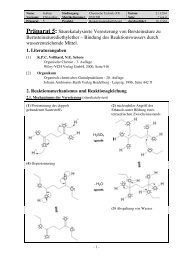
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
3.2. Potentiometrische Bestimmung von Acetylsalicylsäure
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Gruppe3: Name entfernt, Name entfernt, Christopher Gallian, Name entfernt Versuch T3<br />
Studiengang: Chemische Technik Datum: 07.04.09<br />
Thema: <strong>Bestimmung</strong> <strong>von</strong> <strong>Acetylsalicylsäure</strong> in Schmerzmitteln Seite: 24 <strong>von</strong> 41<br />
Bei der Durchführung der Titration gibt es zwei Möglichkeiten:<br />
1) Man verseift zunächst die ganze vorliegende <strong>Acetylsalicylsäure</strong> (ASS) mit<br />
Natronlauge und titriert die Überschüssige Natronlauge mit Salzsäure zurück.<br />
2) Man titriert die schwache ASS direkt mit Natronlauge.<br />
Wir haben uns aus folgenden Gründen für die zweite Methode entschieden:<br />
Bei der Verseifung der ASS entsteht Essigsäure, die den Gesamtelektrolytgehalt<br />
erhöht und damit eventuell die Linearität der Kurve beeinflussen könnte.<br />
Außerdem ist das Verseifen und wieder Abkühlen der Proben zeit- und<br />
arbeitsintensiv. Um effizient zu arbeiten ist die zweite Methode also besser geeignet.<br />
Als Reagenzien brauchen wir Natronlauge, eine Urtitersubstanz für die Natronlauge<br />
(z.B. Oxalsäure oder KHP), Ethanol da die Löslichkeit <strong>von</strong> ASS in einem Ethanol-<br />
Wasser-Gemisch besser ist, als in reinem Wasser, ggf. ein „Leitfähigkeitswasser“ um<br />
die Funktionalität der Messzelle zu überprüfen (z.B. gesättigte NaCl-Lösung)<br />
4.7. Der Titer der Natronlauge<br />
Um den Titer der Natronlauge zu bestimmen wiegt man ungefähr so viel<br />
Urtitersubstanz genau ein, um die gleiche Konzentration der Urtiterlösung zu<br />
bekommen, wie die Maßlösung hat. (Berechnung: m = M * c * V)<br />
Ein Aliquot dieser Lösung wird in ein Becherglas gegeben, mit etwas VE-Wasser<br />
verdünnt und auf einem Magnetrührer gerührt. Nun werden nach und nach definierte<br />
Volumina an Maßlösung zugegeben. Um eine „gute“ Kurve zu bekommen, sollte man<br />
ungefähr so viel Maßlösung zugeben, bis die Leitfähigkeit wieder den Wert wie zu<br />
Beginn der Titration hat. Die Kurve wird nun am Computer gezeichnet und der<br />
Äquivalenzpunkt ermittelt.<br />
Weiß man den Verbrauch am Äquivalenzpunkt, kann man den Titer berechnen:<br />
V ( KHP)<br />
⋅ c<br />
wobei<br />
t<br />
( KHP)<br />
hier<br />
=<br />
mol<br />
25mL<br />
⋅ 0,<br />
012 ⋅t<br />
L<br />
2,<br />
45076g<br />
c(<br />
KHP)<br />
=<br />
1000mL<br />
( KHP)<br />
⋅ t(<br />
KHP)<br />
⋅ z(<br />
KHP)<br />
= V ( NaOH ) ⋅ c(<br />
NaOH )<br />
Einwaage<br />
Einwaage<br />
praktisch<br />
theoretisch<br />
( KHP)<br />
⋅1<br />
= V ( NaOH )<br />
=<br />
0,<br />
012<br />
tatsächlich<br />
250mg<br />
⎯⎯⎯<br />
⎯ →<br />
= 1,<br />
030<br />
245,<br />
076mg<br />
mol<br />
L<br />
mol<br />
⋅ 0,<br />
1 ⋅ t(<br />
NaOH )<br />
L<br />
damit<br />
⎯ ⎯⎯ →V<br />
( NaOH ) = 3mL<br />
⋅t<br />
( NaOH ) ⋅ z(<br />
NaOH )<br />
Durch Einsetzen der Einwaage, und des Verbrauchs am Äquivalenzpunkt kann man<br />
also den Titer der Natronlauge berechen.<br />
4.8. Gehaltbestimmung der Probe