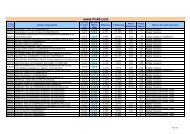
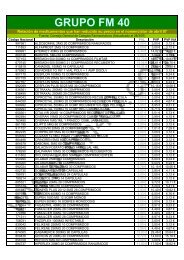
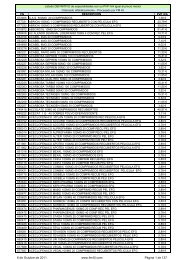
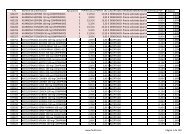
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
CAPÍTULO II<br />
De <strong>la</strong>s garantías exigibles a los medicamentos de uso<br />
humano e<strong>la</strong>borados industrialmente y de <strong>la</strong>s condiciones<br />
de prescripción y dispensación de los mismos<br />
Artículo 9. Autorización y registro.<br />
1. Ningún medicamento e<strong>la</strong>borado industrialmente<br />
podrá ser puesto en el mercado sin <strong>la</strong> previa autorización<br />
de <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios e inscripción en el Registro de Medicamentos<br />
o sin haber obtenido <strong>la</strong> autorización de<br />
conformidad con lo dispuesto en <strong>la</strong>s normas europeas<br />
que establecen los procedimientos comunitarios para <strong>la</strong><br />
autorización y control de los medicamentos de uso<br />
humano y veterinario y que regu<strong>la</strong> <strong>la</strong> Agencia Europea<br />
de Medicamentos.<br />
2. Cuando un medicamento haya obtenido una<br />
autorización, de acuerdo con el apartado anterior, toda<br />
dosificación, forma farmacéutica, vía de administración<br />
y presentaciones adicionales, así como cualesquiera<br />
otras modificaciones y ampliaciones que se introduzcan,<br />
deberán ser objeto de autorización. Todas estas<br />
autorizaciones se considerarán pertenecientes a <strong>la</strong><br />
misma autorización global de comercialización, en particu<strong>la</strong>r<br />
a los efectos de <strong>la</strong> aplicación de los periodos de<br />
exclusividad de datos.<br />
3. Toda modificación, transmisión y extinción de<br />
<strong>la</strong>s autorizaciones de los medicamentos deberá constar<br />
en el Registro de Medicamentos que a estos efectos<br />
tendrá, <strong>del</strong> mismo modo que <strong>la</strong> inscripción, carácter<br />
constitutivo.<br />
4. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios procederá de oficio a <strong>la</strong> incorporación<br />
al Registro de Medicamentos de <strong>la</strong>s autorizaciones<br />
otorgadas por <strong>la</strong> Comisión Europea conforme al Reg<strong>la</strong>mento<br />
(CE) n.º 726/2004/CE.<br />
Artículo 10. Garantías exigibles para <strong>la</strong> autorización<br />
de medicamentos.<br />
1. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios otorgará <strong>la</strong> autorización a un medicamento<br />
si satisface <strong>la</strong>s siguientes condiciones:<br />
a) Alcanzar los requisitos de calidad que se establezcan.<br />
b) Ser seguro, no produciendo en condiciones normales<br />
de utilización efectos tóxicos o indeseables desproporcionados<br />
al beneficio que procura.<br />
c) Ser eficaz en <strong>la</strong>s indicaciones terapéuticas para<br />
<strong>la</strong>s que se ofrece.<br />
d) Estar correctamente identificado.<br />
e) Suministrar <strong>la</strong> información precisa, en formato<br />
accesible y de forma comprensible por el paciente, para<br />
su correcta utilización.<br />
2. La evaluación de los efectos terapéuticos positivos<br />
<strong>del</strong> medicamento se apreciarán en re<strong>la</strong>ción con<br />
cualquier riesgo re<strong>la</strong>cionado con <strong>la</strong> calidad, <strong>la</strong> seguridad<br />
y <strong>la</strong> eficacia <strong>del</strong> medicamento para <strong>la</strong> salud <strong>del</strong><br />
paciente o <strong>la</strong> salud pública, entendido como re<strong>la</strong>ción<br />
beneficio/riesgo.<br />
3. Lo establecido en este artículo será asimismo<br />
de aplicación a <strong>la</strong>s modificaciones que se produzcan en<br />
<strong>la</strong> autorización y habrá de observarse durante toda <strong>la</strong><br />
vida <strong>del</strong> medicamento.<br />
4. El titu<strong>la</strong>r de <strong>la</strong> autorización o, en su caso, el<br />
fabricante deben contar con los medios materiales y<br />
personales, <strong>la</strong> organización y <strong>la</strong> capacidad operativa<br />
suficientes para su correcta fabricación.<br />
Artículo 11. Garantías de calidad.<br />
1. Todo medicamento deberá tener perfectamente<br />
establecida su composición cualitativa y cuantitativa.<br />
Alternativamente, en el caso de sustancias como <strong>la</strong>s<br />
biológicas en <strong>la</strong>s que esto no sea posible, sus procedimientos<br />
de preparación deben ser reproducibles.<br />
2. El Ministro de Sanidad y Consumo establecerá<br />
el tipo de controles exigibles al <strong>la</strong>boratorio titu<strong>la</strong>r de <strong>la</strong><br />
autorización de comercialización y al fabricante para<br />
garantizar <strong>la</strong> calidad de <strong>la</strong>s materias primas, de los productos<br />
intermedios, <strong>del</strong> proceso de fabricación y <strong>del</strong><br />
producto final, incluyendo envasado y conservación, a<br />
efectos de <strong>la</strong> autorización y registro, manteniéndose<br />
dichos controles mientras dure <strong>la</strong> producción y/o<br />
comercialización <strong>del</strong> medicamento. Los procedimientos<br />
de control de calidad habrán de modificarse conforme<br />
al avance de <strong>la</strong> técnica.<br />
3. La Real Farmacopea Españo<strong>la</strong> es el código que<br />
establece <strong>la</strong> calidad que deben cumplir los principios<br />
activos y excipientes que entran en <strong>la</strong> composición de<br />
los medicamentos de uso humano y veterinario. Se<br />
actualizará y publicará periódicamente.<br />
El Ministerio de Sanidad y Consumo a través de <strong>la</strong><br />
Agencia Españo<strong>la</strong> de Medicamentos y Productos Sanitarios<br />
fijará y publicará en el «Boletín Oficial <strong>del</strong> Estado»<br />
<strong>la</strong> fecha de <strong>la</strong> puesta en vigor de los sucesivos<br />
volúmenes de <strong>la</strong> Real Farmacopea Españo<strong>la</strong>.<br />
4. La Real Farmacopea Españo<strong>la</strong> está constituida<br />
por <strong>la</strong>s monografías contenidas en <strong>la</strong> Farmacopea<br />
Europea <strong>del</strong> Consejo de Europa y, en casos justificados,<br />
por <strong>la</strong>s monografías peculiares españo<strong>la</strong>s. Para <strong>la</strong>s<br />
sustancias fabricadas en países pertenecientes a <strong>la</strong><br />
Unión Europea rige, en defecto de <strong>la</strong> Farmacopea<br />
Europea, <strong>la</strong> monografía de <strong>la</strong> farmacopea <strong>del</strong> país fabricante<br />
y, en su defecto, <strong>la</strong> de un tercer país. La Farmacopea<br />
incluirá monografías convenientemente ordenadas<br />
y codificadas con <strong>la</strong>s especificaciones de identidad,<br />
pureza y riqueza de, como mínimo, los principios activos<br />
y excipientes, así como los métodos analíticos oficiales<br />
y textos generales necesarios para <strong>la</strong> correcta<br />
aplicación de <strong>la</strong>s monografías. Las especificaciones<br />
definidas en <strong>la</strong>s monografías constituyen exigencias<br />
652