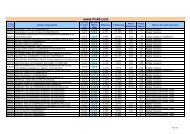
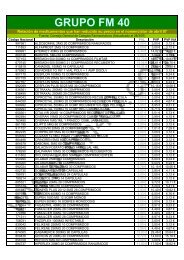
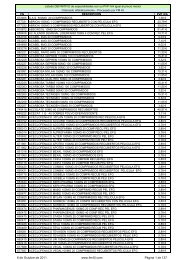
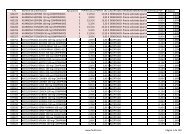
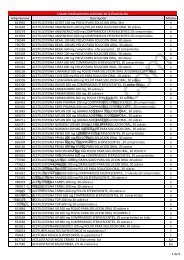
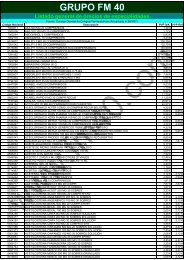
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
6. Cuando se trate de un medicamento que tenga<br />
<strong>la</strong> misma composición cualitativa y cuantitativa en<br />
principios activos y <strong>la</strong> misma forma farmacéutica que<br />
otro ya autorizado e inscrito, el solicitante podrá usar <strong>la</strong><br />
documentación farmacéutica, preclínica y clínica que<br />
obre en el expediente <strong>del</strong> medicamento autorizado<br />
siempre que cuente con el consentimiento <strong>del</strong> titu<strong>la</strong>r.<br />
7. Los medicamentos que contengan principios<br />
activos que entren en <strong>la</strong> composición de medicamentos<br />
autorizados, pero que no hayan sido combinados con<br />
fines terapéuticos, deberán aportar los resultados de los<br />
nuevos ensayos clínicos y de los estudios preclínicos<br />
re<strong>la</strong>tivos a <strong>la</strong> combinación sin necesidad de aportar <strong>la</strong><br />
documentación re<strong>la</strong>tiva a cada principio activo individual.<br />
8. Otorgada <strong>la</strong> autorización de un medicamento,<br />
cualquier modificación que se solicite en re<strong>la</strong>ción con<br />
<strong>la</strong> misma deberá cumplir los requisitos documentales<br />
que reg<strong>la</strong>mentariamente se establezcan.<br />
9. El titu<strong>la</strong>r de <strong>la</strong> autorización de un medicamento<br />
deberá mantener actualizado el expediente aportado<br />
para obtener aquél<strong>la</strong>, incorporando al mismo cuantos<br />
datos, informes o modificaciones tecnológicas impongan<br />
los avances de <strong>la</strong> ciencia y <strong>la</strong>s normas de correcta<br />
fabricación y control. Asimismo, deberá presentar los<br />
informes periódicos de seguridad establecidos reg<strong>la</strong>mentariamente,<br />
con el fin de mantener actualizado el<br />
expediente en materia de seguridad.<br />
10. Las Administraciones públicas competentes<br />
podrán exigir, en cualquier momento, <strong>del</strong> <strong>la</strong>boratorio<br />
farmacéutico que justifique <strong>la</strong> realización de los controles<br />
de calidad y cuantos otros se encuentren establecidos<br />
en <strong>la</strong> normativa vigente.<br />
Artículo 18. Exclusividad de datos.<br />
1. Sin perjuicio <strong>del</strong> derecho re<strong>la</strong>tivo a <strong>la</strong> protección<br />
de <strong>la</strong> propiedad industrial y comercial, los medicamentos<br />
genéricos autorizados con arreglo a lo dispuesto<br />
en el artículo 17.3 no podrán ser comercializados hasta<br />
transcurridos diez años desde <strong>la</strong> fecha de <strong>la</strong> autorización<br />
inicial <strong>del</strong> medicamento de referencia.<br />
Este período de diez años de exclusividad de datos<br />
se ampliará hasta un máximo de once años si, durante<br />
los primeros ocho años <strong>del</strong> período de diez, el titu<strong>la</strong>r de<br />
<strong>la</strong> autorización <strong>del</strong> medicamento de referencia, obtiene<br />
una autorización para una o varias nuevas indicaciones<br />
terapéuticas y, durante <strong>la</strong> evaluación científica previa a<br />
su autorización, se establece que dichas indicaciones<br />
aportarán un beneficio clínico significativo en comparación<br />
con <strong>la</strong>s terapias existentes.<br />
2. En el supuesto de que para una sustancia de uso<br />
médico bien establecido se autorice una nueva indicación,<br />
con base en ensayos clínicos o estudios preclínicos<br />
significativos, se concederá un periodo no acumu<strong>la</strong>tivo<br />
de exclusividad de datos de un año.<br />
3. Cuando, con base en ensayos clínicos o estudios<br />
preclínicos significativos, <strong>la</strong> autorización de medicamento<br />
sujeto a prescripción médica se haya modificado<br />
por <strong>la</strong> de medicamento no sujeto a prescripción<br />
médica o viceversa, se concederá un período de un año<br />
de exclusividad de datos para los mismos.<br />
Artículo 19. Condiciones de prescripción y dispensación<br />
de medicamentos.<br />
1. En <strong>la</strong> autorización <strong>del</strong> medicamento, <strong>la</strong> Agencia<br />
Españo<strong>la</strong> de Medicamentos y Productos Sanitarios<br />
determinará sus condiciones de prescripción c<strong>la</strong>sificándolo,<br />
según corresponda, en <strong>la</strong>s siguientes categorías:<br />
a) Medicamento sujeto a prescripción médica.<br />
b) Medicamento no sujeto a prescripción médica.<br />
2. Estarán en todo caso sujetos a prescripción<br />
médica los medicamentos que se encuentren en alguno<br />
de los siguientes supuestos:<br />
a) Puedan presentar un peligro, directa o indirectamente,<br />
incluso en condiciones normales de uso, si se<br />
utilizan sin control médico.<br />
b) Se utilicen frecuentemente, y de forma muy<br />
considerable, en condiciones anormales de utilización,<br />
y ello pueda suponer, directa o indirectamente, un peligro<br />
para <strong>la</strong> salud.<br />
c) Contengan sustancias o preparados a base de<br />
dichas sustancias, cuya actividad y/o reacciones adversas<br />
sea necesario estudiar más detal<strong>la</strong>damente.<br />
d) Se administren por vía parenteral, salvo casos<br />
excepcionales, por prescripción médica.<br />
3. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá establecer, en los medicamentos<br />
que sólo pueden dispensarse bajo prescripción<br />
médica, <strong>la</strong>s siguientes subcategorías:<br />
a) Medicamentos de dispensación bajo prescripción<br />
médica renovable o no renovable.<br />
b) Medicamentos sujetos a prescripción médica<br />
especial.<br />
c) Medicamentos de dispensación bajo prescripción<br />
médica restringida, de utilización reservada a<br />
determinados medios especializados.<br />
Reg<strong>la</strong>mentariamente se establecerán los criterios<br />
para su aplicación.<br />
4. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá calificar como medicamentos<br />
no sujetos a prescripción médica aquéllos que vayan<br />
destinados a procesos o condiciones que no necesiten<br />
un diagnóstico preciso y cuyos datos de evaluación<br />
toxicológica, clínica o de su utilización y vía de administración<br />
no exijan prescripción médica, de modo que<br />
dichos medicamentos puedan ser utilizados para autocuidado<br />
de <strong>la</strong> salud, mediante su dispensación en <strong>la</strong><br />
656