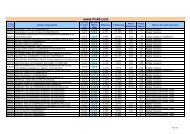
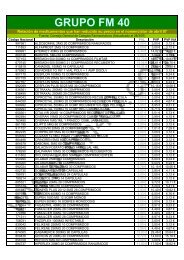
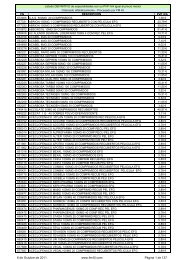
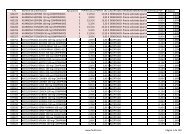
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
aportado para obtener aquél<strong>la</strong>, incorporando al mismo<br />
cuantos datos, informes o modificaciones tecnológicas<br />
impongan los avances de <strong>la</strong> ciencia y <strong>la</strong>s normas de<br />
correcta fabricación y control. Asimismo, deberá presentar<br />
los informes periódicos de seguridad establecidos<br />
reg<strong>la</strong>mentariamente, con el fin de mantener actualizado<br />
el expediente en materia de seguridad.<br />
10. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios o <strong>la</strong>s Comunidades Autónomas<br />
podrán exigir, en cualquier momento, <strong>del</strong> <strong>la</strong>boratorio<br />
farmacéutico que justifique <strong>la</strong> realización de los controles<br />
de calidad y cuantos otros se encuentren establecidos<br />
en <strong>la</strong> autorización y registro de aquél.<br />
Artículo 34. Exclusividad de datos.<br />
1. Sin perjuicio <strong>del</strong> derecho re<strong>la</strong>tivo a <strong>la</strong> protección<br />
de <strong>la</strong> propiedad industrial y comercial, los medicamentos<br />
genéricos veterinarios autorizados con arreglo a<br />
lo dispuesto en el artículo 33.3 no podrán ser comercializados<br />
hasta transcurridos diez años desde <strong>la</strong> fecha de<br />
<strong>la</strong> autorización inicial <strong>del</strong> medicamento de referencia.<br />
No obstante, los expedientes de los medicamentos<br />
veterinarios destinados a peces, abejas y otras especies<br />
que se determine en el ámbito de <strong>la</strong> Unión Europea,<br />
contarán con un periodo de exclusividad de datos de<br />
trece años.<br />
Para los medicamentos veterinarios destinados a<br />
especies productoras de alimentos el período de diez<br />
años al que se refiere el párrafo anterior se podrá<br />
ampliar hasta un máximo de trece años conforme a <strong>la</strong>s<br />
condiciones que reg<strong>la</strong>mentariamente se establezcan.<br />
2. En el supuesto de que a una sustancia de uso<br />
veterinario bien establecido se le otorgue, con base en<br />
nuevos estudios de residuos y nuevos ensayos clínicos,<br />
una autorización para otra especie productora de alimentos,<br />
se concederá a esa especie un periodo de<br />
exclusividad de datos de tres años.<br />
Artículo 35. Causas de denegación, suspensión o<br />
revocación de <strong>la</strong> autorización.<br />
1. Serán causas de denegación, suspensión o<br />
revocación de <strong>la</strong> autorización de un medicamento<br />
veterinario:<br />
a) Que <strong>la</strong> re<strong>la</strong>ción beneficio-riesgo <strong>del</strong> medicamento<br />
veterinario no sea favorable en <strong>la</strong>s condiciones<br />
de empleo autorizadas. Cuando se refiera a medicamentos<br />
veterinarios de uso zootécnico se tendrán especialmente<br />
en cuenta los beneficios en materia de salud<br />
y bienestar de los animales, así como de inocuidad para<br />
el consumidor.<br />
b) Que el medicamento veterinario no tenga efecto<br />
terapéutico o que esté insuficientemente justificado<br />
respecto de <strong>la</strong> especie animal que deba someterse a tratamiento.<br />
c) Que el medicamento veterinario no tenga <strong>la</strong><br />
composición cualitativa o cuantitativa dec<strong>la</strong>rada.<br />
d) Que el tiempo de espera indicado sea insuficiente<br />
para que los productos alimenticios procedentes<br />
<strong>del</strong> animal tratado no contengan residuos que puedan<br />
presentar peligros para <strong>la</strong> salud <strong>del</strong> consumidor, o esté<br />
insuficientemente justificado.<br />
e) Que el medicamento veterinario se presente a <strong>la</strong><br />
venta para una utilización no autorizada.<br />
f) El incumplimiento de <strong>la</strong>s obligaciones establecidas<br />
reg<strong>la</strong>mentariamente.<br />
g) Cualquiera otro supuesto en el que <strong>la</strong> Agencia<br />
Europea de Medicamentos así lo hubiere acordado.<br />
2. La suspensión y revocación a que se refiere el<br />
apartado anterior se producirá, según lo establecido en<br />
el mismo, previas <strong>la</strong>s correspondientes actuaciones de<br />
inspección y control realizadas por <strong>la</strong> Administración<br />
General <strong>del</strong> Estado, en su caso, o por <strong>la</strong>s Comunidades<br />
Autónomas.<br />
3. Las resoluciones de denegación, suspensión o<br />
revocación de <strong>la</strong> autorización de un medicamento veterinario<br />
serán motivadas y se adoptarán previo informe<br />
<strong>del</strong> comité competente de <strong>la</strong> Agencia Españo<strong>la</strong> de<br />
Medicamentos y Productos Sanitarios en materia de<br />
evaluación de medicamentos de uso veterinario, en el<br />
que deberá estar representado el Ministerio de Agricultura,<br />
Pesca y Alimentación.<br />
Artículo 36. Validez de <strong>la</strong> autorización.<br />
1. La autorización de medicamentos veterinarios<br />
tendrá una duración de cinco años.<br />
2. La autorización podrá renovarse transcurridos<br />
cinco años, previa reevaluación de <strong>la</strong> re<strong>la</strong>ción beneficio<br />
riesgo. La renovación de <strong>la</strong> autorización tendrá carácter<br />
indefinido, salvo que razones de farmacovigi<strong>la</strong>ncia justifiquen<br />
su sometimiento a un nuevo procedimiento de<br />
renovación.<br />
3. El titu<strong>la</strong>r de una autorización comunicará, de<br />
forma expresa, a <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos<br />
y Productos Sanitarios <strong>la</strong> puesta en el mercado por<br />
vez primera de un medicamento autorizado y efectuará<br />
anualmente una dec<strong>la</strong>ración de comercialización en los<br />
términos que reg<strong>la</strong>mentariamente se establezcan.<br />
4. La autorización de un medicamento veterinario<br />
se entenderá caducada si, en un p<strong>la</strong>zo de tres años,<br />
el titu<strong>la</strong>r no procede a <strong>la</strong> comercialización efectiva <strong>del</strong><br />
mismo o una vez autorizado, inscrito y comercializado<br />
deja de encontrarse de forma efectiva en el mercado<br />
durante tres años consecutivos. Lo anterior no será<br />
de aplicación cuando concurran razones de salud o de<br />
interés sanitario o circunstancias excepcionales; en tal<br />
caso, <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios mantendrá <strong>la</strong> validez de <strong>la</strong> autorización<br />
y podrá exigir <strong>la</strong> comercialización efectiva <strong>del</strong><br />
producto.<br />
662