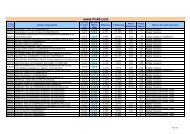
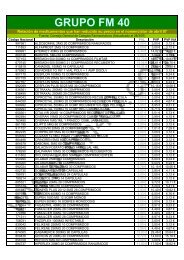
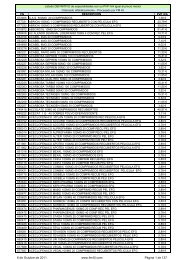
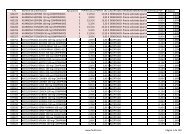
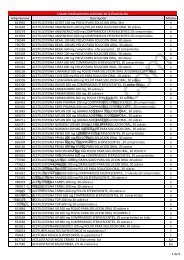
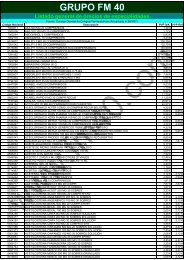
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
Hecho imponible<br />
1.6. Procedimiento de modificación de <strong>la</strong> autorización de un medicamento de uso humano,<br />
calificada de tipo 1.b) en el Reg<strong>la</strong>mento (CE) número 1084/2003, de <strong>la</strong> Comisión Europea,<br />
de 3 de junio de 2003, re<strong>la</strong>tivo al examen de <strong>la</strong>s modificaciones de los términos de<br />
<strong>la</strong>s autorizaciones de comercialización de medicamentos para uso humano y medicamentos<br />
veterinarios concedidas por <strong>la</strong> autoridad competente de un Estado miembro.<br />
1.7. Procedimiento de modificación de <strong>la</strong> autorización de un medicamento de uso humano,<br />
calificada de tipo 1.a) en el Reg<strong>la</strong>mento (CE) número 1084/2003, de <strong>la</strong> Comisión Europea,<br />
de 3 de junio de 2003, re<strong>la</strong>tivo al examen de <strong>la</strong>s modificaciones de los términos de<br />
<strong>la</strong>s autorizaciones de comercialización de medicamentos para uso humano y medicamentos<br />
veterinarios concedidas por <strong>la</strong> autoridad competente de un Estado miembro.<br />
Importe<br />
en euros<br />
1.142,43<br />
662,50<br />
1.8 Procedimiento de renovación de <strong>la</strong> autorización de medicamento de uso humano. 2.142,44<br />
1.9 Presentación de dec<strong>la</strong>ración anual simple de intención de comercializar un medicamento<br />
de uso humano ya autorizada.<br />
109,92<br />
1.10 Procedimiento de autorización para <strong>la</strong> «importación parale<strong>la</strong>» de un medicamento de 675,75<br />
uso humano.<br />
1.11 Procedimiento de modificación de <strong>la</strong> autorización para <strong>la</strong> «importación parale<strong>la</strong>» de un 335,17<br />
medicamento de uso humano.<br />
1.12 Procedimiento de renovación de <strong>la</strong> autorización para <strong>la</strong> «importación parale<strong>la</strong>» de un 335,17<br />
medicamento de uso humano.<br />
1.13 Expedición de certificado europeo de liberación de lote para vacunas y hemoderivados 675,75<br />
de uso humano cuando se requiere el análisis de un granel y de un medicamento de uso<br />
humano.<br />
1.14 Expedición de certificado europeo de liberación de lote para vacunas y hemoderivados 335,17<br />
de uso humano cuando se requiere el análisis de un medicamento de uso humano.<br />
1.15 Evaluación de informe periódico de seguridad de un medicamento a) Semestrales y<br />
anuales: 350<br />
b) Trienales:<br />
2120<br />
<strong>Grupo</strong> II. Medicamentos de p<strong>la</strong>ntas medicinales<br />
Hecho imponible<br />
2.1 Procedimiento simplificado de autorización de un medicamento tradicional a base de<br />
p<strong>la</strong>ntas.<br />
2.2 Procedimiento de autorización e inscripción en el registro de un medicamento a base de<br />
p<strong>la</strong>ntas, excepto 2.1.<br />
2.3 Procedimiento de transmisión de <strong>la</strong> titu<strong>la</strong>ridad de <strong>la</strong> autorización de un medicamento de<br />
p<strong>la</strong>ntas medicinales.<br />
2.4 Procedimiento de modificación de <strong>la</strong>s condiciones de autorización de comercialización<br />
de un medicamento de p<strong>la</strong>ntas medicinales, definidas como de «importancia mayor» en<br />
el Reg<strong>la</strong>mento (CE) núm. 1084/2003 de <strong>la</strong> Comisión Europea, de 3 de junio de 2003.<br />
2.5 Procedimiento de modificación de <strong>la</strong>s condiciones de autorización de comercialización<br />
de un medicamento de p<strong>la</strong>ntas medicinales, definidas como de «importancia menor» en<br />
el Reg<strong>la</strong>mento (CE) núm. 1084/2003 de <strong>la</strong> Comisión Europea, de 3 de junio de 2003.<br />
Importe<br />
–<br />
Euros<br />
2.000,00<br />
7.713,25<br />
432,07<br />
1.142,43<br />
510,00<br />
690