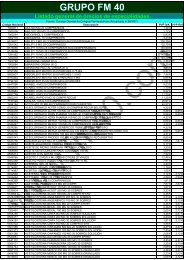
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
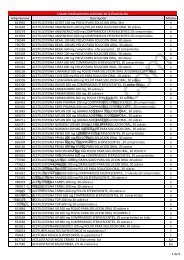
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
en <strong>la</strong> que cada vez tiene más importancia el uso de<br />
medicamentos sin prescripción en <strong>la</strong>s condiciones que<br />
se establecen, pero que debe ser realizada en el marco<br />
de un uso racional <strong>del</strong> medicamento, a cuyos fines es<br />
imprescindible el papel <strong>del</strong> farmacéutico en todo lo<br />
re<strong>la</strong>cionado con una automedicación responsable.<br />
El capítulo III regu<strong>la</strong> los medicamentos veterinarios,<br />
lo que constituye una auténtica novedad de <strong>la</strong> Ley, que<br />
acoge una concepción de estos medicamentos alejada<br />
de <strong>la</strong> consideración de medicamentos especiales. Se<br />
regu<strong>la</strong>n como medicamentos dotados de características<br />
propias, toda vez que por efecto de <strong>la</strong> normativa<br />
comunitaria europea de aplicación, los citados medicamentos<br />
han de cumplir <strong>la</strong>s garantías generales de<br />
calidad, seguridad y eficacia para <strong>la</strong> salvaguardia de <strong>la</strong><br />
salud y el bienestar de los animales, así como <strong>la</strong> salud<br />
pública. Por este motivo se ha considerado necesario<br />
incorporar a <strong>la</strong> Ley un capítulo donde se regulen específicamente<br />
los aspectos fundamentales de estos<br />
medicamentos.<br />
Asimismo, se incorpora como reg<strong>la</strong> general <strong>la</strong> exigencia<br />
de prescripción veterinaria previa a <strong>la</strong> dispensación<br />
de medicamentos destinados a los animales productores<br />
de alimentos y se regu<strong>la</strong> el sistema español de<br />
farmacovigi<strong>la</strong>ncia veterinaria, necesario por cuanto <strong>la</strong><br />
Directiva 2001/82/CE impone el necesario refuerzo de<br />
los sistemas de farmacovigi<strong>la</strong>ncia.<br />
El capítulo IV se refiere a <strong>la</strong>s garantías sanitarias<br />
de <strong>la</strong>s fórmu<strong>la</strong>s magistrales y preparados oficinales.<br />
Las primeras son preparadas con sustancias de acción<br />
e indicación reconocidas legalmente en España en <strong>la</strong>s<br />
oficinas de farmacia y servicios farmacéuticos legalmente<br />
establecidos que dispongan de los medios<br />
necesarios para su preparación. Los preparados oficinales<br />
deberán cumplir determinadas condiciones,<br />
entre <strong>la</strong>s que destaca <strong>la</strong> necesidad de presentarse y<br />
dispensarse bajo principio activo, denominación<br />
común internacional (DCI) o, en su defecto, denominación<br />
común o científica y en ningún caso bajo<br />
marca comercial.<br />
El capítulo V regu<strong>la</strong> <strong>la</strong>s garantías sanitarias de los<br />
medicamentos especiales, entendiendo como tales a<br />
aquellos medicamentos que por sus características particu<strong>la</strong>res<br />
requieren una regu<strong>la</strong>ción específica. En esta<br />
categoría se incluyen <strong>la</strong>s vacunas y demás medicamentos<br />
biológicos, los medicamentos de origen humano,<br />
los medicamentos de terapia avanzada, los radiofármacos,<br />
los medicamentos con sustancias psicoactivas con<br />
potencial adictivo, los medicamentos homeopáticos,<br />
los de p<strong>la</strong>ntas medicinales y los gases medicinales. De<br />
entre todos ellos, debe destacarse a los medicamentos<br />
de terapia celu<strong>la</strong>r. El texto pretende ac<strong>la</strong>rar que <strong>la</strong> Ley y<br />
<strong>la</strong> normativa europea re<strong>la</strong>tiva a garantías y condiciones<br />
de autorización serán aplicables sólo a los que se fabriquen<br />
industrialmente; el resto de medicamentos, que no<br />
estén destinados a <strong>la</strong> producción industrial, aún cuando<br />
concurran en ellos <strong>la</strong>s características y condiciones<br />
establecidas en <strong>la</strong>s definiciones de «medicamento de<br />
terapia génica» o de «medicamento de terapia celu<strong>la</strong>r<br />
somática», tendrán <strong>la</strong> regu<strong>la</strong>ción que reg<strong>la</strong>mentariamente<br />
se determine.<br />
En materia de farmacovigi<strong>la</strong>ncia, tanto de medicamentos<br />
de uso humano como de uso veterinario, el<br />
capítulo VI regu<strong>la</strong> <strong>la</strong>s actividades de salud pública tendentes<br />
a <strong>la</strong> identificación, cuantificación, evaluación y<br />
prevención de los riesgos <strong>del</strong> uso de los medicamentos<br />
una vez comercializados, permitiendo así el seguimiento<br />
de sus posibles efectos adversos, siendo de destacar<br />
el sistema español de farmacovigi<strong>la</strong>ncia, en el que <strong>la</strong>s<br />
Administraciones sanitarias han de realizar lo necesario<br />
para recoger, e<strong>la</strong>borar y, en su caso, procesar toda <strong>la</strong><br />
información útil para <strong>la</strong> supervisión de medicamentos<br />
y, en particu<strong>la</strong>r, <strong>la</strong> información sobre reacciones adversas<br />
a los mismos, así como para <strong>la</strong> realización de cuantos<br />
estudios se consideren necesarios para evaluar su<br />
seguridad.<br />
V<br />
El título III regu<strong>la</strong>, bajo <strong>la</strong> rúbrica «de <strong>la</strong>s garantías<br />
de <strong>la</strong> investigación de los medicamentos de uso humano»,<br />
los ensayos clínicos con medicamentos. Destaca<br />
como novedad, y como garantía de transparencia, <strong>la</strong><br />
posibilidad de que <strong>la</strong> Administración sanitaria pueda<br />
publicar los resultados de los ensayos clínicos cuando<br />
dicha publicación no se haya llevado a cabo por el<br />
promotor <strong>del</strong> mismo en p<strong>la</strong>zo y siempre que los citados<br />
resultados permitan concluir que el producto presenta<br />
modificaciones de su perfil de eficacia o de<br />
seguridad; y ello, porque se toma en especial consideración<br />
el interés que, tanto para los pacientes que han<br />
participado en el ensayo como para los médicos y para<br />
<strong>la</strong> pob<strong>la</strong>ción en general, reviste el poder conocer los<br />
resultados <strong>del</strong> mismo, si de éstos se deriva que el<br />
medicamento p<strong>la</strong>ntea problemas de eficacia o de<br />
seguridad. Además, se mantiene el régimen de autorización<br />
administrativa previa, respetando los derechos<br />
fundamentales de <strong>la</strong> persona y los postu<strong>la</strong>dos éticos<br />
que afectan a <strong>la</strong> investigación biomédica, y <strong>la</strong> necesidad<br />
de que se cump<strong>la</strong>n <strong>la</strong>s normas de buena práctica<br />
clínica como requisitos indispensables para garantizar<br />
<strong>la</strong> idoneidad <strong>del</strong> ensayo. Del mismo modo se mantienen<br />
<strong>la</strong>s garantías de indemnización para los sujetos<br />
que pudieran verse perjudicados por su participación<br />
en los ensayos clínicos mediante <strong>la</strong> exigencia <strong>del</strong> aseguramiento<br />
previo de los daños y perjuicios que<br />
pudieran derivarse de aquéllos.<br />
Por otra parte, <strong>la</strong> Ley faculta al Ministerio de Sanidad<br />
y Consumo para el desarrollo de acciones que permitan<br />
que los Comités Éticos de Investigación clínica<br />
acreditados por <strong>la</strong>s Comunidades Autónomas puedan<br />
compartir estándares de calidad y criterios de evaluación<br />
adecuados y homogéneos en el conjunto <strong>del</strong> Sistema<br />
Nacional de Salud.<br />
646