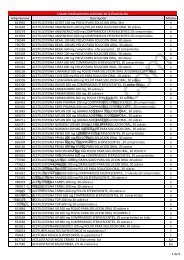
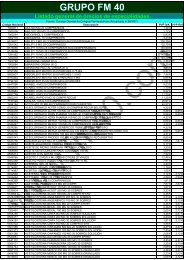
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
Artículo 39. Garantías de disponibilidad de medicamentos<br />
veterinarios en situaciones específicas y<br />
autorizaciones especiales.<br />
1. En circunstancias excepcionales, <strong>la</strong> Agencia<br />
Españo<strong>la</strong> de Medicamentos y Productos Sanitarios<br />
podrá conceder una autorización supeditada a <strong>la</strong> obligación<br />
por parte <strong>del</strong> solicitante de cumplir determinadas<br />
condiciones revisables anualmente. Dichas condiciones<br />
quedarán, en especial, referidas a <strong>la</strong> seguridad <strong>del</strong><br />
medicamento, a <strong>la</strong> información a <strong>la</strong>s autoridades competentes<br />
de todo incidente re<strong>la</strong>cionado con su utilización<br />
y a <strong>la</strong>s medidas que deben adoptarse. Reg<strong>la</strong>mentariamente<br />
se establecerán los criterios para <strong>la</strong> obtención<br />
de estas autorizaciones.<br />
2. Sin perjuicio <strong>del</strong> régimen de prescripciones<br />
excepcionales, el Ministerio de Sanidad y Consumo, de<br />
acuerdo con el Ministerio de Agricultura, Pesca y Alimentación,<br />
regu<strong>la</strong>rá, con carácter excepcional, <strong>la</strong> utilización<br />
de medicamentos por los veterinarios en condiciones<br />
distintas a <strong>la</strong>s autorizadas, con el fin de asegurar<br />
el bienestar animal y evitar sufrimientos innecesarios a<br />
los animales o por motivos de sanidad animal. Esta<br />
regu<strong>la</strong>ción deberá establecerse, en todo caso, de conformidad<br />
con lo dispuesto en <strong>la</strong> legis<strong>la</strong>ción sobre sanidad<br />
animal.<br />
3. En caso de epizootias graves, <strong>la</strong> Agencia Españo<strong>la</strong><br />
de Medicamentos y Productos Sanitarios, previa<br />
solicitud e informe preceptivo <strong>del</strong> Ministerio de Agricultura,<br />
Pesca y Alimentación, podrá permitir provisionalmente<br />
<strong>la</strong> utilización de medicamentos inmunológicos<br />
veterinarios sin autorización, si no existe el<br />
medicamento adecuado, informando previamente sobre<br />
sus condiciones de utilización a <strong>la</strong> Comisión Europea.<br />
Artículo <strong>40</strong>. Ensayos clínicos con medicamentos de<br />
uso veterinario.<br />
1. A los efectos de esta Ley se entiende por ensayo<br />
clínico en animales con un medicamento en investigación,<br />
a toda investigación efectuada a través de su<br />
administración o aplicación a <strong>la</strong> especie de destino, o a<br />
una categoría particu<strong>la</strong>r de <strong>la</strong> misma, a <strong>la</strong> que se pretende<br />
destinar el futuro tratamiento, orientado a confirmar<br />
cuando se estime oportuno los efectos farmacodinámicos<br />
y/o farmacocinéticos y/o establecer <strong>la</strong> eficacia para<br />
una indicación terapéutica y/o conocer el perfil de sus<br />
reacciones adversas y establecer <strong>la</strong> seguridad y/o tolerancia<br />
en <strong>la</strong>s condiciones normales de uso.<br />
2. Los ensayos clínicos en animales con medicamentos<br />
en investigación estarán sometidos a régimen<br />
de autorización de <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos<br />
y Productos Sanitarios, conforme al procedimiento<br />
reg<strong>la</strong>mentariamente establecido. Deberá cumplirse,<br />
además, <strong>la</strong> normativa aplicable en materia de protección<br />
de los animales utilizados para experimentación y<br />
otros fines científicos.<br />
Artículo 41. Sistema Español de Farmacovigi<strong>la</strong>ncia<br />
de medicamentos veterinarios.<br />
1. El Sistema Español de Farmacovigi<strong>la</strong>ncia de<br />
medicamentos veterinarios tiene por objeto <strong>la</strong> identificación,<br />
cuantificación, evaluación y prevención de los<br />
riesgos <strong>del</strong> uso de los medicamentos veterinarios y<br />
seguimiento de los posibles efectos adversos de éstos<br />
en los animales, <strong>la</strong>s personas o el medio ambiente, así<br />
como <strong>la</strong> presunta falta de eficacia y <strong>la</strong> detección de<br />
tiempos de espera inadecuados.<br />
2. Reg<strong>la</strong>mentariamente se desarrol<strong>la</strong>rá el Sistema<br />
Español de Farmacovigi<strong>la</strong>ncia de medicamentos veterinarios<br />
que, coordinado por <strong>la</strong> Agencia Españo<strong>la</strong> de<br />
Medicamentos y Productos Sanitarios y conforme establece<br />
el artículo 57 de esta Ley, integrará <strong>la</strong>s actividades<br />
que <strong>la</strong>s Administraciones sanitarias realicen para<br />
recoger y e<strong>la</strong>borar <strong>la</strong> información sobre reacciones<br />
adversas a los medicamentos de uso veterinario.<br />
3. Los <strong>la</strong>boratorios farmacéuticos, los veterinarios,<br />
los farmacéuticos y demás profesionales sanitarios<br />
tienen el deber de comunicar a <strong>la</strong> Agencia Españo<strong>la</strong> de<br />
Medicamentos y Productos Sanitarios, de <strong>la</strong> manera<br />
que se determine reg<strong>la</strong>mentariamente, <strong>la</strong>s sospechas de<br />
reacciones adversas de <strong>la</strong>s que tengan conocimiento y<br />
que puedan haber sido causadas por medicamentos<br />
veterinarios.<br />
CAPÍTULO IV<br />
De <strong>la</strong>s garantías sanitarias de <strong>la</strong>s fórmu<strong>la</strong>s<br />
magistrales y preparados oficinales<br />
Artículo 42. Requisitos de <strong>la</strong>s fórmu<strong>la</strong>s magistrales.<br />
1. Las fórmu<strong>la</strong>s magistrales serán preparadas<br />
con sustancias de acción e indicación reconocidas<br />
legalmente en España, de acuerdo con el artículo 44.1<br />
de esta Ley y según <strong>la</strong>s directrices <strong>del</strong> Formu<strong>la</strong>rio<br />
Nacional.<br />
2. Las fórmu<strong>la</strong>s magistrales se e<strong>la</strong>borarán en <strong>la</strong>s<br />
oficinas de farmacia y servicios farmacéuticos legalmente<br />
establecidos que dispongan de los medios necesarios<br />
para su preparación de acuerdo con <strong>la</strong>s exigencias<br />
establecidas en el Formu<strong>la</strong>rio Nacional.<br />
No obstante, <strong>la</strong>s oficinas de farmacia y servicios<br />
farmacéuticos que no dispongan de los medios necesarios,<br />
excepcionalmente y sin perjuicio de lo establecido<br />
en el artículo 67.2, podrán encomendar a una entidad<br />
de <strong>la</strong>s previstas en esta Ley, autorizada por <strong>la</strong> Administración<br />
sanitaria competente, <strong>la</strong> realización de una o<br />
varias fases de <strong>la</strong> e<strong>la</strong>boración y/o control de fórmu<strong>la</strong>s<br />
magistrales.<br />
3. En <strong>la</strong> preparación de fórmu<strong>la</strong>s magistrales se<br />
observarán <strong>la</strong>s normas de correcta e<strong>la</strong>boración y control<br />
de calidad de fórmu<strong>la</strong>s magistrales y preparados<br />
oficinales.<br />
664