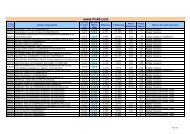
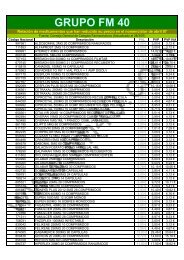
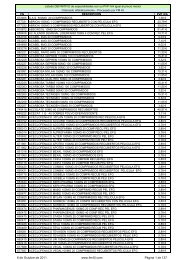
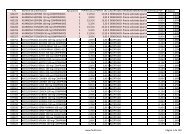
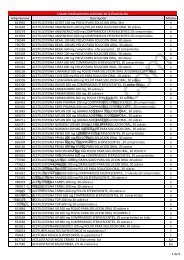
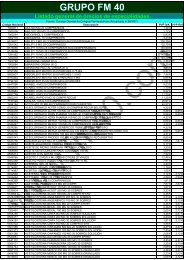
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
Artículo 23. Modificaciones de <strong>la</strong> autorización por<br />
razones de interés general.<br />
La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá modificar <strong>la</strong> autorización de los medicamentos<br />
que lo requieran por razones de interés público<br />
o defensa de <strong>la</strong> salud o seguridad de <strong>la</strong>s personas.<br />
Artículo 24. Garantías de disponibilidad de medicamentos<br />
en situaciones específicas y autorizaciones<br />
especiales.<br />
1. En circunstancias excepcionales, <strong>la</strong> Agencia<br />
Españo<strong>la</strong> de Medicamentos y Productos Sanitarios<br />
podrá conceder una autorización supeditada a <strong>la</strong> obligación<br />
por parte <strong>del</strong> solicitante de cumplir determinadas<br />
condiciones revisables anualmente. Dichas condiciones<br />
quedarán, en especial, referidas a <strong>la</strong> seguridad <strong>del</strong><br />
medicamento, a <strong>la</strong> información a <strong>la</strong>s autoridades competentes<br />
de todo incidente re<strong>la</strong>cionado con su utilización<br />
y a <strong>la</strong>s medidas que deben adoptarse. Reg<strong>la</strong>mentariamente<br />
se establecerán los criterios para <strong>la</strong> concesión<br />
de estas autorizaciones.<br />
2. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá de oficio o a solicitud de <strong>la</strong>s<br />
Comunidades Autónomas interesadas, por razones<br />
sanitarias objetivas y debidamente motivadas, sujetar a<br />
reservas singu<strong>la</strong>res <strong>la</strong> autorización de medicamentos<br />
que así lo requieran por su naturaleza o características,<br />
así como sus condiciones generales de prescripción y<br />
dispensación.<br />
3. La prescripción y <strong>la</strong> aplicación de medicamentos<br />
no autorizados a pacientes no incluidos en un ensayo<br />
clínico con el fin de atender como uso compasivo<br />
necesidades especiales de tratamientos de situaciones<br />
clínicas de pacientes concretos se regu<strong>la</strong>rá reg<strong>la</strong>mentariamente,<br />
con pleno respeto a lo establecido en <strong>la</strong> legis<strong>la</strong>ción<br />
vigente en materia de autonomía <strong>del</strong> paciente y<br />
de los derechos y obligaciones en materia de información<br />
y documentación clínica.<br />
El Ministro de Sanidad y Consumo establecerá <strong>la</strong>s<br />
condiciones para <strong>la</strong> prescripción de medicamentos<br />
autorizados cuando se utilicen en condiciones distintas<br />
a <strong>la</strong>s autorizadas, que en todo caso tendrá carácter<br />
excepcional.<br />
4. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá autorizar <strong>la</strong> importación de<br />
medicamentos no autorizados en España siempre que<br />
estén legalmente comercializados en otros Estados,<br />
cuando esta importación resulte imprescindible para <strong>la</strong><br />
prevención, el diagnóstico o el tratamiento de patologías<br />
concretas por no existir en España alternativa adecuada<br />
autorizada para esa indicación concreta o por<br />
situaciones de desabastecimiento que lo justifiquen.<br />
5. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios podrá autorizar temporalmente <strong>la</strong><br />
distribución de medicamentos no autorizados, en respuesta<br />
a <strong>la</strong> propagación supuesta o confirmada de un<br />
agente patógeno o químico, toxina o radiación nuclear<br />
capaz de causar daños. En estas circunstancias, si se<br />
hubiere recomendado o impuesto por <strong>la</strong> autoridad competente<br />
el uso de medicamentos en indicaciones no<br />
autorizadas o de medicamentos no autorizados, los titu<strong>la</strong>res<br />
de <strong>la</strong> autorización y demás profesionales que<br />
intervengan en el proceso estarían exentos de responsabilidad<br />
civil o administrativa por todas <strong>la</strong>s consecuencias<br />
derivadas de <strong>la</strong> utilización <strong>del</strong> medicamento, salvo<br />
por los daños causados por productos defectuosos.<br />
6. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios autorizará con carácter excepcional <strong>la</strong><br />
e<strong>la</strong>boración y distribución de muestras gratuitas en <strong>la</strong>s<br />
condiciones que reg<strong>la</strong>mentariamente se establezcan. En<br />
todo caso, no se autorizarán muestras gratuitas de<br />
medicamentos de sustancias psicoactivas que causen<br />
dependencia y de aquel<strong>la</strong>s otras que determine <strong>la</strong> Agencia<br />
Españo<strong>la</strong> de Medicamentos y Productos Sanitarios.<br />
CAPÍTULO III<br />
De <strong>la</strong>s garantías exigibles a los medicamentos de uso<br />
veterinario e<strong>la</strong>borados industrialmente y de <strong>la</strong>s condiciones<br />
de prescripción y dispensación de los mismos<br />
Artículo 25. Autorización y registro.<br />
1. Ningún medicamento veterinario e<strong>la</strong>borado<br />
industrialmente podrá ser puesto en el mercado sin <strong>la</strong><br />
previa autorización de <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos<br />
y Productos Sanitarios e inscripción en el<br />
Registro de Medicamentos o sin haber obtenido <strong>la</strong><br />
autorización de conformidad con lo dispuesto en <strong>la</strong>s<br />
normas europeas, que establecen los procedimientos<br />
comunitarios para <strong>la</strong> autorización y control de los<br />
medicamentos de uso humano y veterinarios y que<br />
regu<strong>la</strong>n <strong>la</strong> Agencia Europea de Medicamentos. A efectos<br />
de lo establecido en este artículo y, en general, en<br />
este capítulo, <strong>la</strong> Agencia Españo<strong>la</strong> de Medicamentos y<br />
Productos Sanitarios actuará de acuerdo con los criterios<br />
emanados <strong>del</strong> Ministerio de Agricultura, Pesca y<br />
Alimentación y conforme a <strong>la</strong> normativa de sanidad<br />
animal.<br />
2. Cuando un medicamento veterinario haya obtenido<br />
una autorización, de acuerdo con el apartado anterior,<br />
toda dosificación, forma farmacéutica, vía de<br />
administración y presentaciones adicionales, así como<br />
cualesquiera otras modificaciones y ampliaciones que<br />
se introduzcan, deberán ser objeto de autorización y<br />
formarán parte de <strong>la</strong> misma.<br />
3. Toda modificación, transmisión y extinción de<br />
<strong>la</strong>s autorizaciones de los medicamentos veterinarios<br />
deberá constar en el Registro de Medicamentos que a<br />
estos efectos tendrá, <strong>del</strong> mismo modo que <strong>la</strong> inscripción,<br />
carácter constitutivo.<br />
4. La Agencia Españo<strong>la</strong> de Medicamentos y Productos<br />
Sanitarios procederá de oficio a <strong>la</strong> incorporación<br />
al Registro de Medicamentos de <strong>la</strong>s autorizaciones<br />
658