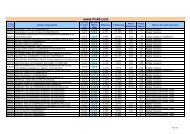
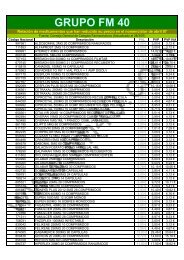
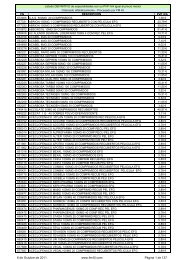
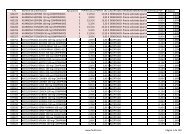
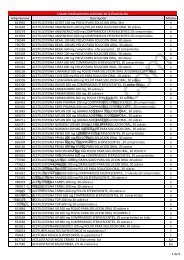
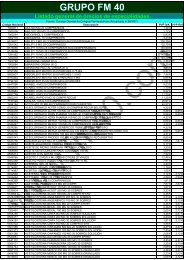
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Bienvenido a la WEB del Grupo FM 40
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Congreso 14 de julio de 2006.—Serie A. Núm. 66-15<br />
donantes identificados a través <strong>del</strong> correspondiente<br />
registro de donantes. Estos centros autorizados deberán<br />
adoptar <strong>la</strong>s medidas precisas de control, vigi<strong>la</strong>ncia y<br />
trazabilidad que impidan <strong>la</strong> transmisión de enfermedades<br />
infecciosas.<br />
3. La importación y <strong>la</strong> autorización como medicamentos<br />
de los derivados de <strong>la</strong> sangre y <strong>del</strong> p<strong>la</strong>sma<br />
podrá ser denegada o revocada cuando aquél<strong>la</strong> no proceda<br />
de donaciones altruistas realizadas en bancos de<br />
sangre o centros de p<strong>la</strong>smaféresis, ubicados en los países<br />
miembros de <strong>la</strong> Unión Europea que reúnan <strong>la</strong>s debidas<br />
garantías.<br />
4. La importación y <strong>la</strong> autorización como medicamentos<br />
<strong>del</strong> resto de sustancias de origen humano mencionadas<br />
en el apartado 1, así como de sus correspondientes<br />
derivados, será denegada o revocada cuando no<br />
proceda de donantes identificados mediante el correspondiente<br />
registro, o cuando no se haya obtenido en<br />
centros autorizados que reúnan <strong>la</strong>s medidas precisas de<br />
control, vigi<strong>la</strong>ncia y trazabilidad exigidas en el apartado<br />
2 de este artículo.<br />
5. La autorización como medicamentos de los<br />
derivados de <strong>la</strong> sangre y <strong>del</strong> p<strong>la</strong>sma podrá condicionarse<br />
a <strong>la</strong> presentación por el solicitante de documentación<br />
que acredite que el precio <strong>del</strong> medicamento no incluye<br />
beneficio ilegítimo sobre <strong>la</strong> sangre donada de forma<br />
altruista.<br />
Las Administraciones sanitarias promoverán <strong>la</strong>s<br />
donaciones de sangre altruistas así como el desarrollo<br />
de <strong>la</strong> producción y utilización de los hemoderivados<br />
provenientes de estas donaciones.<br />
Artículo 47. Medicamentos de terapia avanzada.<br />
1. Se considera «medicamento de terapia génica»,<br />
el producto obtenido mediante un conjunto de procesos<br />
de fabricación destinados a transferir, in vivo o ex vivo,<br />
un gen profiláctico, de diagnóstico o terapéutico, tal<br />
como un fragmento de ácido nucleico, a célu<strong>la</strong>s<br />
humanas/animales y su posterior expresión in vivo. La<br />
transferencia genética supone un sistema de expresión<br />
contenido en un sistema de distribución conocido como<br />
vector, que puede ser de origen viral o no viral. El vector<br />
puede incluirse asimismo en una célu<strong>la</strong> humana o<br />
animal.<br />
2. Se considera «medicamento de terapia celu<strong>la</strong>r<br />
somática» <strong>la</strong> utilización en seres humanos de célu<strong>la</strong>s<br />
somáticas vivas, tanto autólogas, procedentes <strong>del</strong> propio<br />
paciente, como alogénicas, procedentes de otro ser<br />
humano, o xenogénicas, procedentes de animales,<br />
cuyas características biológicas han sido alteradas sustancialmente<br />
como resultado de su manipu<strong>la</strong>ción para<br />
obtener un efecto terapéutico, diagnóstico o preventivo<br />
por medios metabólicos, farmacológicos e inmunológicos.<br />
Dicha manipu<strong>la</strong>ción incluye <strong>la</strong> expansión o activación<br />
de pob<strong>la</strong>ciones celu<strong>la</strong>res autólogas ex vivo, tal<br />
como <strong>la</strong> inmunoterapia adoptiva, y <strong>la</strong> utilización de<br />
célu<strong>la</strong>s alogénicas y xenogénicas asociadas con productos<br />
sanitarios empleados ex vivo o in vivo, tales<br />
como microcápsu<strong>la</strong>s, matrices y andamiajes intrínsecos,<br />
biodegradables o no biodegradables.<br />
3. Los criterios y exigencias generales de esta Ley,<br />
así como <strong>la</strong> normativa europea re<strong>la</strong>tiva a <strong>la</strong>s garantías<br />
exigibles y condiciones de autorización, serán de aplicación<br />
a los medicamentos de terapia avanzada a que se<br />
refiere este artículo, siempre que se fabriquen industrialmente.<br />
El Gobierno determinará reg<strong>la</strong>mentariamente <strong>la</strong><br />
aplicación de esta Ley a los medicamentos de terapia<br />
avanzada cuando, aún concurriendo en ellos <strong>la</strong>s características<br />
y condiciones establecidas en <strong>la</strong>s definiciones<br />
de «medicamento de terapia génica» o de «medicamento<br />
de terapia celu<strong>la</strong>r somática», no hayan sido fabricados<br />
industrialmente.<br />
Artículo 48. Radiofármacos.<br />
1. A los efectos de esta Ley se entenderá por:<br />
a) Radiofármaco: cualquier producto que, cuando<br />
esté preparado para su uso con finalidad terapéutica o<br />
diagnóstica, contenga uno o más radionucleidos (isótopos<br />
radiactivos).<br />
b) Generador: cualquier sistema que incorpore un<br />
radionucleido (radionucleido padre) que en su desintegración<br />
origine otro radionucleido (radionucleido hijo)<br />
que se utilizará como parte integrante de un radiofármaco.<br />
c) Equipo reactivo: cualquier preparado industrial<br />
que deba combinarse con el radionucleido para obtener<br />
el radiofármaco final.<br />
d) Precursor: todo radionucleido producido industrialmente<br />
para el marcado radiactivo de otras sustancias<br />
antes de su administración.<br />
2. Sin perjuicio de <strong>la</strong>s demás obligaciones que<br />
vengan impuestas por disposición legal o reg<strong>la</strong>mentaria,<br />
<strong>la</strong> fabricación industrial y <strong>la</strong> autorización y registro<br />
de los generadores, equipos reactivos, precursores y<br />
radiofármacos requerirá <strong>la</strong> autorización previa de <strong>la</strong><br />
Agencia Españo<strong>la</strong> de Medicamentos y Productos Sanitarios,<br />
otorgada de acuerdo con los principios generales<br />
de esta Ley y según <strong>la</strong>s exigencias y procedimientos<br />
que reg<strong>la</strong>mentariamente se establezcan.<br />
3. La autorización prevista en el apartado anterior<br />
no será exigida para <strong>la</strong> preparación extemporánea de un<br />
radiofármaco, en una unidad de radiofarmacia autorizada,<br />
bajo <strong>la</strong> supervisión y control de un facultativo especialista<br />
en radiofarmacia, para su aplicación en un centro<br />
o institución legalmente facultados para ello, si se<br />
realiza exclusivamente a partir de generadores, equipos<br />
reactivos y precursores autorizados y con arreglo a <strong>la</strong>s<br />
instrucciones <strong>del</strong> fabricante.<br />
4. La autorización prevista en el apartado segundo<br />
no será exigida para <strong>la</strong> preparación de muestras autólogas<br />
dónde participen radionucleidos, así como <strong>la</strong> extrac-<br />
666