Rapport d'activités 2004 - FNR
Rapport d'activités 2004 - FNR
Rapport d'activités 2004 - FNR
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>FNR</strong><br />
La Directive 2003/89 du Parlement Européen et du Conseil prescrit un étiquetage spécifique pour les<br />
aliments contenant des allergènes «cachés» à partir du 25 novembre 2005. Des méthodes d’analyse et<br />
de détection de ces allergènes seront nécessaires afin de permettre les contrôles adéquats.<br />
Le présent projet a pour objectif de développer des technologies améliorant la traçabilité des<br />
constituants de produits alimentaires : une approche protéique, par des anticorps monoclonaux,<br />
permettant de détecter directement certains allergènes, et une approche ADN pour identifier l’origine<br />
des différents constituants. Les allergènes visés sont des parvalbumines animales, et des Lipid Transfer<br />
Proteins (LTPs) végétales (voir Figure). L’identification des espèces animales/végétales se fera à base<br />
de séquences nucléotidiques spécifiques présentes dans les génomes des différentes espèces<br />
considérées. Ont été retenues dans le cadre de cette étude huit espèces animales (bovin, porc, mouton,<br />
cheval, saumon, carpe, maquereau et morue) et huit espèces végétales (blé, maïs, orge, riz, soja,<br />
arachide, noix et sésame). Parmi les cibles technologiques visées figurent l‘élaboration de puces à<br />
protéines et à ADN ainsi que des kits de détection d’allergènes et d’organismes génétiquement<br />
modifiés.<br />
Le projet a débuté en novembre <strong>2004</strong> par une analyse bioinformatique actualisée des allergènes à<br />
l’étude, ainsi que par une mise au point des techniques d’extraction et de séparation des protéines à<br />
partir de plusieurs espèces végétales concernées. Plusieurs séquences codantes de LTPs végétales ont<br />
également été isolées.<br />
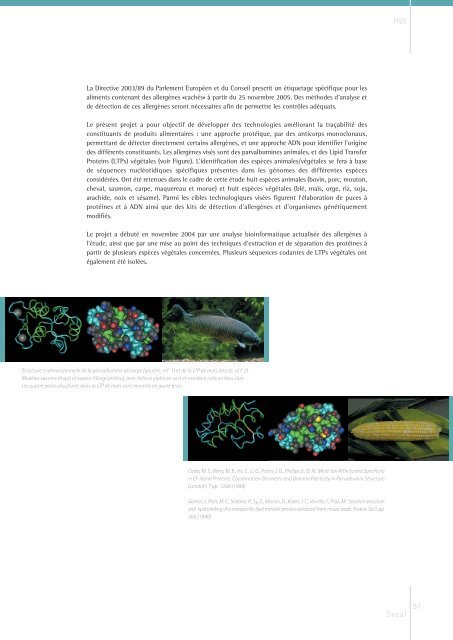
Structure tridimensionnelle de la parvalbumine de carpe (gauche, réf. 1) et de la LTP de maïs (droite, ré f. 2).<br />
Modèles «worm» (haut) et «space filling» (milieu), avec hélices alpha en vert et «random coil» en bleu clair.<br />
Les quatre ponts disulfures dans la LTP de maïs sont montrés en jaune brun.<br />
Cates, M. S., Berry, M. B., Ho, E., Li, Q., Potter, J. D., Phillips Jr., G. N.: Metal Ion Affinity and Specificity<br />
in EF-Hand Proteins: Coordination Geometry and Domain Plasticity in Parvalbumin Structure<br />
(London) 7 pp. 1269 (1999)<br />
Gomar, J., Petit, M. C., Sodano, P., Sy, D., Marion, D., Kader, J. C., Vovelle, F., Ptak, M.: Solution structure<br />
and lipid binding of a nonspecific lipid transfer protein extracted from maize seeds. Protein Sci 5 pp.<br />
565 (1996)<br />
Secal<br />
97