Сахарный диабет - Новая Медицина Тысячелетия
Сахарный диабет - Новая Медицина Тысячелетия
Сахарный диабет - Новая Медицина Тысячелетия
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
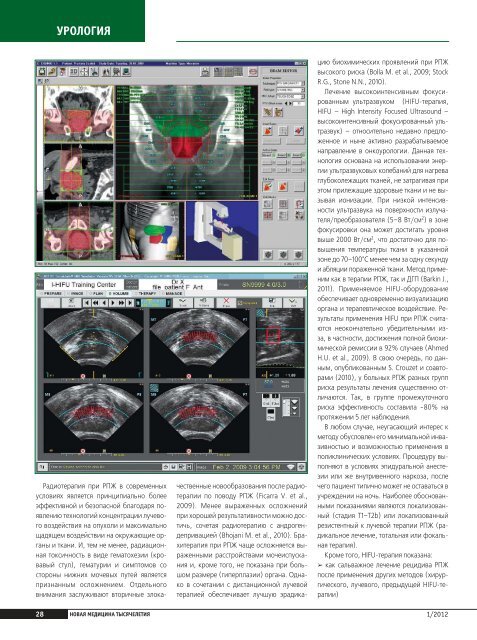
УРОЛОГИЯУРОЛОГИЯРадиотерапия при РПЖ в современныхусловиях является принципиально болееэффективной и безопасной благодаря появлениютехнологий концентрации лучевоговоздействия на опухоли и максимальнощадящем воздействии на окружающие органыи ткани. И, тем не менее, радиационнаятоксичность в виде гематохезии (кровавыйстул), гематурии и симптомов состороны нижних мочевых путей являетсяпризнанным осложнением. Отдельноговнимания заслуживают вторичные злокачественныеновообразования после радиотерапиипо поводу РПЖ (Ficarra V. et al.,2009). Менее выраженных осложненийпри хорошей результативности можно достичь,сочетая радиотерапию с андрогендепривацией(Bhojani M. et al., 2010). Брахитерапияпри РПЖ чаще осложняется выраженнымирасстройствами мочеиспусканияи, кроме того, не показана при большомразмере (гиперплазии) органа. Однаков сочетании с дистанционной лучевойтерапией обеспечивает лучшую эрадикациюбиохимических проявлений при РПЖвысокого риска (Bolla M. et al., 2009; StockR.G., Stone N.N., 2010).Лечение высокоинтенсивным фокусированнымультразвуком (HIFU-терапия,HIFU – High Intensity Focused Ultrasound –высокоинтенсивный фокусированный ультразвук)– относительно недавно предложенноеи ныне активно разрабатываемоенаправление в онкоурологии. Данная технологияоснована на использовании энергииультразвуковых колебаний для нагреваглубоколежащих тканей, не затрагивая приэтом прилежащие здоровые ткани и не вызываяионизации. При низкой интенсивностиультразвука на поверхности излучателя/преобразователя(5–8 Вт/см 2 ) в зонефокусировки она может достигать уровнявыше 2000 Вт/см 2 , что достаточно для повышениятемпературы ткани в указаннойзоне до 70–100°С менее чем за одну секундуи абляции пораженной ткани. Метод применимкак в терапии РПЖ, так и ДГП (Barkin J.,2011). Применяемое HIFU-оборудованиеобеспечивает одновременно визуализациюоргана и терапевтическое воздействие. Результатыприменения HIFU при РПЖ считаютсянеокончательно убедительными изза,в частности, достижения полной биохимическойремиссии в 92% случаев (AhmedH.U. et al., 2009). В свою очередь, по данным,опубликованным S. Crouzet и соавторами(2010), у больных РПЖ разных групприска результаты лечения существенно отличаются.Так, в группе промежуточногориска эффективность составила ~80% напротяжении 5 лет наблюдения.В любом случае, неугасающий интерес кметоду обусловлен его минимальной инвазивностьюи возможностью применения вполиклинических условиях. Процедуру выполняютв условиях эпидуральной анестезииили же внутривенного наркоза, послечего пациент типично может не оставаться вучреждении на ночь. Наиболее обоснованнымипоказаниями являются локализованный(стадия Т1–Т2b) или локализованныйрезистентный к лучевой терапии РПЖ (радикальноелечение, тотальная или фокальнаятерапия).Кроме того, HIFU-терапия показана:➢ как сальважное лечение рецидива РПЖпосле применения других методов (хирургического,лучевого, предыдущей HIFU-терапии)Применению низких температур в медицине положилначало Джеймс Арнот (J. Arnott) в 1845–1851 годах,который с целью обезболивания и лечения опухолевыхзаболеваний кожи, матки и молочной железы применялаппликации из солевых растворов, смешанных сольдом, достигая температуры до -24°С. Метод получилдальнейшее развитие с применением жидкого СО, которыйохлаждался при переходе в газообразное состояние,образуя хлопья “снега”. Спрессованный в специальныеаппликаторы “снег” применялся для лечениязаболеваний кожи до 1960-х годов. Внедрение внутритканевыхметаллических аппликаторов позволилоприменять метод также для лечения опухолей головногомозга и внутренних органов.В ХХ веке широкое применение приобрел жидкийазот, а температура аппликатора достигала -196°С.Первые попытки применения сверхнизких температурпри раке простаты были сделаны в 60-х годах прошлогостолетия W.A. Soanes и сотрудниками (1966). В качествекриоагента использовался жидкий азот, а образованиельда контролировалось через открытый доступили же трансуретрально, причем метод применялсяпри как злокачественных, так и доброкачественных новообразованиях.Несовершенство криохирургическихаппаратов того времени обусловило необычайнобольшое количества осложнений и, в результате, неприятиеметода урологическим сообществом (GonderM.J. et al., 1966; Loening S.A. et al., 1984).В 2000 году появилось третье поколение криохирургическихмашин, действие которых основывается наэффекте Джоуля-Томпсона. Суть эффекта заключаетсяв изменении температуры окружающей среды прирасширении некоторых газов. Так, аргон при переходеиз состояния высокого давления (20 МПа в баллоне) внизкое (0,1 МПа на кончике криозонда) способен охлаждатьсядо -185°С. Криозонд представляет собойзакрытый контур, и аргон возвращается в криомашину,откуда выходит в окружающий воздух. Гелий в тех жеусловиях, наоборот, нагревается до 67 Кельвинов,позволяя производить активное оттаивание послекаждого из циклов заморозки (Ghafar M.A. et al., 2001).Оба газа инертны и не представляют опасности дляприсутствующих в операционной.Американская урологическая ассоциация (AUA) исключилакриоабляцию простаты из списка экспериментальныхметодов в 1996 году, и с этого моментатаковая стала использоваться в основном для леченияпациентов с рецидивом заболевания после лучевойтерапии (Pisters L.L. et al., 1997). По мере же накопленияклинического опыта, процедура стала все ширеприменяться у первичных больных и сегодня занимаетзаслуженное место среди малоинвазивных методиклечения рака предстательной железы.Редакционный материал.Источник: Жернов А.А. и соавт, 2010.Интерес к криохирургии усилился в начале 1990-х годов,чему способствовал технический прогресс в областиультразвуковой визуализации, а также развитиекомпьютерной техники. Основным отличием второгопоколения криохирургической аппаратуры было использованиетрансректальных ультразвуковых датчиковдля контроля за процессом установки криозондов идальнейшего промораживания. Системы для трансперинеальноговведения криозондов обозначили перспективностьметода, хотя уровень осложнений был всееще достаточно высоким, что объяснялось сложностьюконтроля за охлаждающим действием жидкого азота,неэффективностью систем подогрева уретры, а такжеотсутствием данных о температуре тканей (Chang Z. etal., 1994). Тем не менее, вскоре были получены обнадеживающиерезультаты операций, выполнявшихся с использованиемэкспериментальных систем прогревауретры, а также внутритканевых термодатчиков, позволявшихточно достигать целевой температуры тканей-40°C (Cohen J.K. et al., 1995; Zisman A. et al., 2001).28НОВАЯ МЕДИЦИНА ТЫСЯЧЕЛЕТИЯ1/20121/2012 НОВАЯ МЕДИЦИНА ТЫСЯЧЕЛЕТИЯ 29