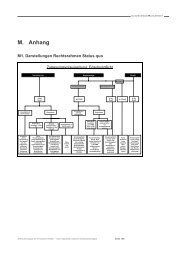
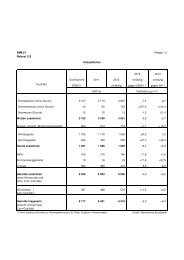
Kopfbogen BM Ilse Aigner - BMELV
Kopfbogen BM Ilse Aigner - BMELV
Kopfbogen BM Ilse Aigner - BMELV
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
SEITE 79 VON 98<br />
fehlte es bisher an einer entsprechenden Rechtsgrundlage, die nunmehr mit § 9 geschaffen<br />
wird. Die Begriffsbestimmung setzt nicht voraus, dass Tierseuchenerreger zu einer<br />
Beeinflussung der Tiergesundheit oder der menschlichen Gesundheit geführt haben. Es reicht<br />
eine Gefährdung aus.<br />
Mit dem Begriff „Beobachtungen“ sind alle Maßnahmen erfasst, die die tatsächlichen<br />
Voraussetzungen für die Feststellung einer Gefährdung der Tiergesundheit oder der<br />
menschlichen Gesundheit schaffen. Beobachtungen sind insbesondere die Besichtigung und<br />
die Analyse, aber ggf. auch die Durchführung von Versuchen. Mit der Durchführung des<br />
Monitorings verbunden ist immer auch eine Probenahme (überwiegend Blut), ohne dass dies<br />
insoweit als Tierversuch im Sinne des § 7 Absatz 1 Tierschutzgesetz anzusehen ist (Absatz 1).<br />
Mit Absatz 2 wird das Bundesministerium ermächtigt, das Nähere zum Monitoring zu regeln.<br />
Zu § 10 (Inverkehrbringen und Anwendung)<br />
Absatz 1 entspricht im Wesentlichen dem § 17c Absatz 1 des bisherigen Tierseuchengesetzes,<br />
stellt aber in der neuen Fassung ausschließlich auf immunologische Tierarzneimittel ab, die<br />
am oder im Tier (Tierimpfstoffe, Tuberkuline, Brucelline) angewendet werden. Es gilt<br />
weiterhin, dass diese immunologischen Tierarzneimittel von der zuständigen<br />
Zulassungsbehörde, dem Paul-Ehrlich-Institut, zuzulassen sind oder deren Inverkehrbringen<br />
durch Rechtsakt der Europäischen Gemeinschaft oder Europäischen Union genehmigt worden<br />
sein muss (Satz 1). Die Regelung zu den bestandsspezifischen Tierimpfstoffen wird<br />
beibehalten; auch zukünftig dürfen bestandsspezifische Impfstoffe vor dem Hintergrund, dass<br />
sie nicht der Zulassung unterliegen, nur inaktiviert in den Verkehr gebracht werden (Satz 2).<br />
In dem neuen Absatz 2 wird nunmehr die Zulassung von Mitteln, die nicht zur Anwendung<br />
am oder im Tier bestimmt sind (In-vitro-Diagnostika (IVD)), geregelt (im geltenden<br />
Tierseuchengesetz in § 17c Absatz 1 Satz 2 geregelt). Dabei gilt, wie bisher schon,<br />
grundsätzlich das Primat der Zulassung für IVD durch die zuständige Bundesoberbehörde,<br />
dem Friedrich-Loeffler-Institut (FLI). Gleichwohl gibt es für die Erkennung vieler<br />
Tierseuchenerreger keine zugelassenen IVD. Auch in diesem Fall muss aber eine Diagnostik<br />
möglich sein. Insoweit wird zukünftig für die Diagnose von Tierseuchenerregern, für die<br />
keine zugelassenen IVD erhältlich sind oder aber für die zugelassene IVD verfügbar sind, im<br />
Rahmen eines Seuchengeschehens aber nicht die nötige Anzahl zur Verfügung steht oder aber<br />
es zu Lieferengpässen seitens der Zulassungsinhaber kommt, ermöglicht, dass Methoden<br />
angewendet werden können, die entweder in der vom FLI veröffentlichten amtlichen<br />
Methodensammlung enthalten sind (vgl. auch § 26 Absatz 4 Satz 1 Nummer 1) oder aber die<br />
in den Untersuchungseinrichtungen an den FLI-Methoden validiert worden sind. Das<br />
Schmallenberggeschehen in jüngster Vergangenheit hat gezeigt, dass weder eine<br />
Nachweismethode in der amtlichen Methodensammlung noch eine Inhouse-Methode<br />
existierte; auch in diesen Fällen muss aber eine Diagnostik möglich sein. Da derartige Fälle