full text
full text
full text
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
"-I' L<br />
32 8 9 Die kovalente Bindung. Das H,-Molekul 3 9 Die kovalente Bindung. Das H,-Molekul 33<br />
Es zeigt sich (siehe Pauliprinzip), das y+ symmetrisch1 in Bezug<br />
auf die Koordinaten ist, wenn die Spins beider Elektronen antiparallel<br />
zueinander gerichtet sind. y- ist antisymmetrisch in Bezug<br />
auf die Koordinaten, wenn die Elektronen gleichgerichtete Spins<br />
besitzen. Die Losung der G1. (36) und (37) fuhrt zu den Energiewerten<br />
des durch die Elektronenwechselwirkung gestorten Systems :<br />
die abstosende und anziehende Wirkung der Ladungsdichte der<br />
beiden Elektronen ya2 (1 ) und yb2 (2) aufeinander und auf die Kerne<br />
nach Masgabe des Potentialansatzes V angibt1. Das Integral X<br />
heist Uberlappungsintegral, weil es nach der Formel<br />
C-A<br />
E-(R) = -----<br />
1-8 tt<br />
Hierin bezeichnen C das Coulomb-, A das Austausch- und X das<br />
Uberlappungsintegral, uber deren Bedeutung weiter unten gesprochen<br />
wird. Sobald die beiden Atome in Wechselwirkung zueinander<br />
treten, liefern die beiden y-1- und y--Funktionen verschiedene<br />
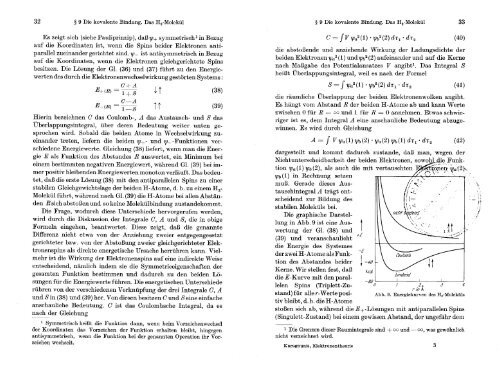
Energiewerte. Gleichung (38) liefert, wenn man die Ener-<br />
gie E als Funktion des Abstandes R auswertet, ein Minimum bei<br />
einem bestimmten negativen Energiewert, wahrend G1. (39) b ei ' im- '<br />
mer positiv bleibenden Energiewerten monoton verlauft. Das bedeutet,<br />
das die erste Losung (38) mit den antiparallelen Spins zu einer<br />
stabilen Gleichgewichtslage der beiden H-Atome, d. h. zu einem H,-<br />
Molekul fuhrt, wahrend nach G1. (39) die H-Atome bei allen Abstanden<br />
Rsich abstosen und so keine Molekulbindung zustandekommt.<br />
Die Frage, wodurch diese Unterschiede hervorgerufen werden,<br />
wird durch die Diskussion der Integrale C, A und X, die in obige<br />
Formeln eingehen, beantwortet. Diese zeigt, das die genannte<br />
Differenz nicht etwa von der Anziehung zweier entgegengesetzt<br />
gerichteter bzw. von der Abstosung zweier gleichgerichteter Elektronenspins<br />
als direkte energetische Ursache herruhren kann. Vielmehr<br />
ist die Wirkung der Elektronenspins auf eine indirekte Weise<br />
entscheidend, namlich indem sie die Symmetrieeigenschaften der<br />
gesamten Funktion bestimmen und dadurch zu den beiden Losungen<br />
fur die Energiewerte fuhren. Die energetischen Unterschiede<br />
ruhren von der verschiedenen Verknupfung der drei Integrale C, A<br />
und X in (38) und (39) her. Von diesen besitzen C und X eine einfache<br />
anschauliche Bedeutung. C ist das Coulombsche Integral, da es<br />
nach der Gleichung<br />
Symmetrisch heist die Funktion dann, wenn beim Vorzeichenwechsel<br />
der Koordinaten das Vorzeichen der Funktion erhalten bleibt, hingegen<br />
antisymmetrisch, wenn die Funktion bei der genannten Operation ihr Vorzeichen<br />
wechselt.<br />
die raumliche Uberlappung der beiden Elektronenwolken angibt.<br />
Es hangt vom Abstand R der beiden H-Atome ab und kann Werte<br />
zwischen 0 fur R = W und 1 fur R = 0 annehmen. Etwas schwieriger<br />
ist es, dem Integral A eine anschauliche Bedeutung abzugewinnen.<br />
Es wird durch Gleichung<br />
dargestellt und kommt dadurch zustande, das man, wegen der<br />
Nichtunterscheidbarkeit der beiden Elektronen, sowohLdie Funktion<br />
~ ~ ( yb(2), 1 ) als auch die mit vertauschten e