Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext
Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext
Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext Blindtext
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
halten von Apatit- und Whitlockitkeramik,<br />
so stellt sich für die Apatitkeramik<br />
heraus, dass die dichteren Modifikationen<br />
keine sichtbaren Auflösungsoder<br />
Abbauerscheinungen aufweisen,<br />
hochporöse dagegen wegen ihres geringen<br />
Abstandes der einzelnen Poren<br />
untereinander sichtbare Degradationserscheinungen<br />
zeigen (Fallschüssel<br />
1987). Für Tricalciumphosphat bestehen<br />
nach Klein (1983) ähnliche Verhältnisse<br />
nur, wenn es sich um eine<br />
dichte Struktur der Keramik handelt.<br />
Poröse Varianten jedoch zerfallen in<br />
einzelne Partikel, während gleichstrukturierte<br />
Apatitkeramiken lediglich<br />
oberflächliche Auflösungserscheinungen<br />
zeigen.<br />
5. Prinzipien der Gewebereaktionen<br />
auf granuläre Kalziumphosphate<br />
Die Reaktion des Implantatbettes auf<br />
die Störung der Integrität des Gewebes<br />
durch den Fremdkörper wird von<br />
verschiedenen Parametern beeinflusst.<br />
Osborn und Donath (1984) zählen<br />
dazu die Materialdichte, die Korngröße,<br />
den Korngrenzanteil, die Kristallstruktur,<br />
das Sinterungsverhalten, den<br />
Makroporenanteil und den Mikroporenanteil.<br />
Nach Berger (1989), der sich vorwiegend<br />
mit Biovitrokeramen beschäftigte,<br />
ist der unterschiedliche Chemismus<br />
der einzelnen Materialien von ausschlaggebender<br />
Bedeutung für die<br />
Reaktion des Lagergewebes.<br />
Da Kalziumphosphate im Organismus<br />
immer mit Interzellularflüssigkeit in<br />
Kontakt kommen, ist eine Auflösung<br />
an der Oberfläche selbstverständlich.<br />
Wie stark die Auflösung ist, hängt vom<br />
Löslichkeitsprodukt ab. In-vitro-Untersuchungen<br />
haben ergeben, dass die<br />
Löslichkeit von Tricalciumphosphat ungefähr<br />
12-22 mal größer ist als die Löslichkeit<br />
von Hydroxylapatit. Dies gilt<br />
sowohl für das saure als auch für das<br />
basische Milieu. Gleichartiges lassen<br />
auch in-vivo-Untersuchungen erkennen<br />
(stellv f. viele: Driskell et al. 1973).<br />
Tricalciumphosphatkeramiken zeigen<br />
sowohl Auflösungserscheinungen als<br />
auch zellulären Abbau. In-vivo scheint<br />
die Bioresorption sogar bevorzugt zellulär<br />
zu erfolgen. Der Abbau erfolgt<br />
durch Mesenchymzellen, Makropha-<br />
gen und Riesenzellen (Osborn 1985).<br />
TCP-Keramik ist also nicht nur stärker<br />
löslich als Hydroxylapatit, sondern<br />
unterliegt auch einer größeren zellulären<br />
Resorption (Winter et al. 1981).<br />
Für die spezifische Oberfläche der Keramik<br />
ist die Porosität entscheidend.<br />
Die Implantation dichter Hydroxylapatitkeramik<br />
in den Knochen führt<br />
lediglich zu einer Oberflächenerosion<br />
von 0,01-0,015 mm pro Jahr (de Groot<br />
1985). Bei der Implantation in submuköses<br />
Bindegewebe ist die Resorption<br />
dichter Hydroxylapatitgranula durch<br />
mehrkernige Riesenzellen jedoch viel<br />
ausgeprägter als bei der Implantation<br />
in den Knochen (Wagner und Wahlmann<br />
1985).<br />
Auch zwischen verschiedenen Knochenregionen<br />
bestehen Resorptionsunterschiede.<br />
So verläuft zum Beispiel<br />
die Resorption von Tricalciumphosphatkeramik<br />
im Oberkiefer deutlich<br />
langsamer als im Unterkiefer (Horch<br />
und Steegmann 1985).<br />
Weiterhin sind die Korn- und Kristallgrößen<br />
ein entscheidender Faktor bei<br />
der Resorption, da die zwischen die<br />
Korngrenzen mit ihren Zytoplasmafortsätzen<br />
eindringenden Makrophagen<br />
kleine Kristalle leichter aus dem<br />
Kristallverbund herauslösen können.<br />
Bei größeren Kristallen verläuft die<br />
Resorption deutlich langsamer.<br />
Da poröse Keramiken meist kleinere<br />
Kristalle aufweisen, ist deren erhöhte<br />
Resorption auch teilweise auf die geringere<br />
Kristallgröße zurückzuführen.<br />
Auch das Kalzium-Phosphat-Verhältnis<br />
ist als ein entscheidender Faktor<br />
zu nennen.<br />
Bei der experimentellen Gegenüberstellung<br />
von 9 verschiedenen Prüfkörpern<br />
mit den oben genannten Stoffen<br />
im Verhältnis von 1,0 bis 2,0 stellte<br />
sich die Keramik mit einem Calcium-<br />
Phosphat-Verhältnis von 2,0 als die<br />
stabilste heraus. Ausgeprägte Auflösungserscheinungen<br />
sind bei 1,3 – 1,6<br />
nachweisbar, die neben flächenhaften<br />
Resorptionen auch zahlreiche, aus<br />
dem Keramikverband herausgelöste<br />
spitzkantige Keramikpartikel im Zytoplasma<br />
der resorptionsaktiven, einund<br />
mehrkernigen Makrophagen erkennen<br />
lassen. Die geringe Biostabilität<br />
der kalziumarmen Calciumphosphatkeramik<br />
kommt auch im geringen<br />
morphometrischen Wert des Knochen-<br />
Keramik-Kontaktes zum Ausdruck<br />
(Bauer et al. 1986, Donath et al. 1986).<br />
6. Aktuelle klinische Substanzen<br />
6.1 Trikalziumphosphate<br />
Biobase ® (α - TCP)<br />
Biobase ist ein vollsynthetisches, reines<br />
α - TCP, in dessen Granula Mikound<br />
Makroporen vorhanden sind.<br />
Dementsprechend werden dem Material<br />
eine hohe physiko-chemische<br />
Auflösung auch im Inneren der Granula<br />
und anschließende zelluläre<br />
Transportreaktionen bescheinigt, die<br />
nach 1 / - 2 Jahren zur vollständigen<br />
2<br />
Elimination führen sollen. Die Veränderung<br />
der Partikel über eine Implantationszeit<br />
von 200 Tagen am Kaninchen<br />
zeigen Abb. 1, 2 und 3 als sog.<br />
Mikroradiographien und Fluoreszenzmarkierungen.<br />
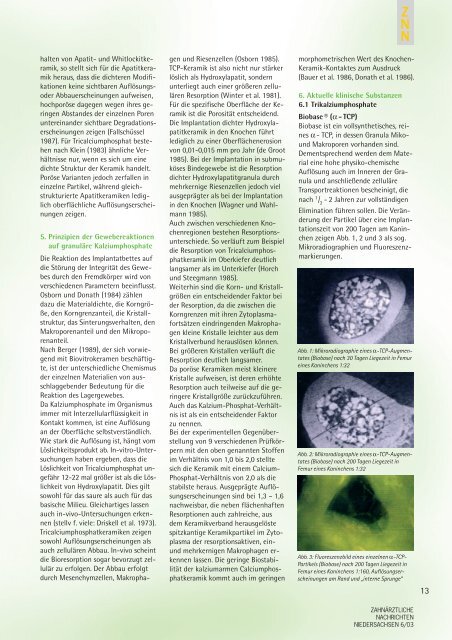
Abb. 1: Mikroradiographie eines α-TCP-Augmentates<br />
(Biobase) nach 30 Tagen Liegezeit in Femur<br />
eines Kaninchens 1:32<br />
Abb. 2: Mikroradiographie eines α-TCP-Augmentates<br />
(Biobase) nach 200 Tagen Liegezeit in<br />
Femur eines Kaninchens 1:32<br />
Abb. 3: Fluoreszenzbild eines einzelnen α-TCP-<br />
Partikels (Biobase) nach 200 Tagen Liegezeit in<br />
Femur eines Kaninchens 1:160, Auflösungserscheinungen<br />
am Rand und „interne Sprunge“<br />
ZAHNÄRZTLICHE<br />
NACHRICHTEN<br />
NIEDERSACHSEN 6/03<br />
13