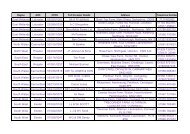
HerdChek* BSE-Scrapie Antigen BOVINE SPONGIFORM ... - Defra
HerdChek* BSE-Scrapie Antigen BOVINE SPONGIFORM ... - Defra
HerdChek* BSE-Scrapie Antigen BOVINE SPONGIFORM ... - Defra
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
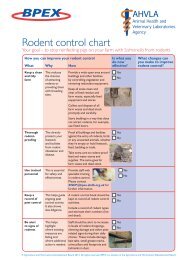
Protocolli per l’esame<br />
Procedura del test<br />
Protocollo<br />
Breve<br />
Protocollo<br />
Ultra-Breve<br />
Protocollo milza/<br />
linfonodi di piccoli<br />
ruminanti<br />
Passaggio<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
10<br />
11<br />
Attività<br />
Aggiunta del<br />
campione<br />
alla piastra di<br />
diluizione<br />
Aggiunta del<br />
campione alla<br />
piastra di cattura<br />
dell’antigene<br />
Incubazione<br />
della piastra di<br />
cattura<br />
Lavare con<br />
soluzione 1 di<br />
lavaggio 1X<br />
Conditioner:<br />
Aggiunta/<br />
Incubazione<br />
Lavare con<br />
soluzione 2 di<br />
lavaggio 1X<br />
Aggiunta del<br />
coniugato<br />
Incubazione del<br />
coniugato<br />
Lavare con<br />
soluzione 2 di<br />
lavaggio 1X<br />
Aggiunta/<br />
Incubazione del<br />
substrato<br />
Aggiunta della<br />
soluzione di<br />
arresto/Lettura<br />
della piastra<br />
18–26°C<br />
Tutti i passaggi<br />
32–37°C 1 : Solo<br />
per l’incubazione<br />
(passaggi 3, 5, 8, 10)<br />
18–26°C: Tutti gli altri<br />
passaggi, inclusi i<br />
passaggi di lavaggio<br />
Tessuto cerebrale: 120 μl di campione con<br />
30 μl di diluente per piastra da lavoro.<br />
18–26°C<br />
Tutti i passaggi<br />
Linfonodi e milza:<br />
100 μl di campione<br />
con 50 μl di diluente<br />
per piastra da lavoro.<br />
MESCOLARE BENE: consultare il capitolo “Diluizione di un<br />
campione in un diluente per piastra da lavoro”.<br />
Pipettare 100 µl di campione diluito sulla piastra per l’esame;<br />
mescolare i controlli, aggiungere 100 µl in duplicato; coprire la<br />
piastra con un coperchio per piastre.<br />
45–60 minuti;<br />
agitare lentamente a<br />
200 ±100 rpm<br />
20–25 minuti;<br />
agitare lentamente<br />
a 200±100 rpm<br />
2–3 ore fermo<br />
Lavare i pozzetti 6 volte con ~350 µl di soluzione 1<br />
di lavaggio 1X<br />
Aggiungere 100 µl di tampone di condizionamento a ciascun<br />
pozzetto; coprire la piastra; incubare per 10 ±1 minuti.<br />
Lavare i pozzetti 3 volte con ~350 µl di soluzione 2<br />
di lavaggio 1X.<br />
Aggiungere 100 µl di coniugato diluito (per tessuto cerebrale<br />
bovino e linfonodi /milza di piccoli ruminanti usare CC; per tessuto<br />
cerebrale di piccoli ruminanti usare SRBCC) e coprire la piastra con<br />
l’apposito coperchio.<br />
45–50 minuti 25–30 minuti 60–75 minuti<br />
Lavare i pozzetti 5 volte con ~350 µl di soluzione 2<br />
di lavaggio 1X<br />
Aggiungere 100 µl di substrato a ciascun pozzetto;<br />
coprire la piastra; incubare per 15 ±1 minuti. Evitare l’esposizione<br />
diretta alla luce.<br />
(non usare coperture adesive)<br />
Aggiungere 100 µl di soluzione di arresto acido; la piastra può<br />
essere tenuta fino ad un massimo di 30 minuti al buio prima della<br />
lettura della densità ottica (450 nm) con una lunghezza d’onda di<br />
riferimento di (A REF<br />
) 620 nm–650 nm.<br />
1. L’incubazione a 32–37 °C viene eseguita posizionando la piastra di analisi in un incubatore preriscaldato a 32–37°C<br />
46