JOURNAL ASMAC No 1 - février 2020
Régénération - A propos d’humains, de coraux et de déchets Diabète - Le scalpel remplace la pompe Immunologie - Immunothérapie – un aperçu Politique - 75 ans de l’asmac – au début était le salaire
Régénération - A propos d’humains, de coraux et de déchets
Diabète - Le scalpel remplace la pompe
Immunologie - Immunothérapie – un aperçu
Politique - 75 ans de l’asmac – au début était le salaire
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Perspectives<br />
Cytotoxic T-lymphocyte associated<br />
antigen 4 (CTLA-4)<br />
Grundsätzlich wird davon ausgegangen,<br />
dass die Blockierung von CTLA-4 eine wesentliche<br />
Rolle während des primings, der<br />
ersten Phase der Aktivierung Antigen-spezifischer,<br />
naiver T-Lymphozyten spielt.<br />
Dieser Schritt erfolgt in der Regel in den<br />
regionären, Tumor-drainierenden<br />
Lymphknoten [2, 5].<br />
Sobald der für ein (Tumor-)Antigen<br />
spezifische T-Zell Rezeptor eines T-Lymphozyten<br />
einen stabilen Kontakt mit dem<br />
Antigen-MHC-Komplex einer APZ etabliert<br />
hat, wird über den T-Zell-Rezeptor<br />
eine aktivierende intrazelluläre Signalkaskade<br />
ausgelöst. Nach diesem ersten Aktivierungsschritt<br />
wird der inhibitorische<br />
Rezeptor CTLA-4 auf den aktivierten<br />
T-Lymphozyten hochreguliert. Dabei<br />
greift CTLA-4 nicht direkt in die Bindung<br />
des Antigen-MHC-T-Zell-Rezeptors ein,<br />
sondern hemmt die weitere T-Zell-Aktivierung<br />
via Kompetition mit dem co-stimulierenden<br />
Molekül CD28. CD28 ist<br />
ebenfalls ein Rezeptor auf der Oberfläche<br />
von T-Lymphozyten und sendet ein aktivierendes<br />
(co-stimulierendes) Signal an<br />
die T-Zellen wenn eine Bindung von CD28<br />
an einen der B7 Liganden B7 – 1 (CD80)<br />
und / oder B7 – 2 (CD86) erfolgt. CTLA-4<br />
besitzt eine deutlich höhere Affinität für<br />
die B7-Liganden als CD28 und verhindert<br />
so eine überschiessende T-Lymphozyten-Aktivierung<br />
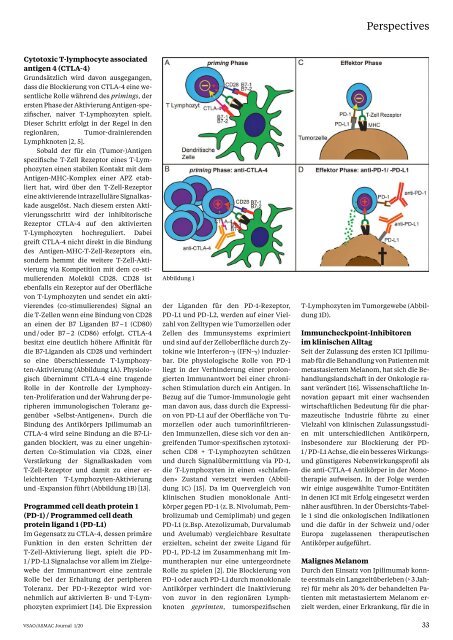
(Abbildung 1A). Physiologisch<br />
übernimmt CTLA-4 eine tragende<br />
Rolle in der Kontrolle der Lymphozyten-Proliferation<br />
und der Wahrung der peripheren<br />
immunologischen Toleranz gegenüber<br />
«Selbst-Antigenen». Durch die<br />
Bindung des Antikörpers Ipilimumab an<br />
CTLA-4 wird seine Bindung an die B7-Liganden<br />
blockiert, was zu einer ungehinderten<br />
Co-Stimulation via CD28, einer<br />
Verstärkung der Signalkaskaden vom<br />
T-Zell-Rezeptor und damit zu einer erleichterten<br />
T-Lymphozyten-Aktivierung<br />
und -Expansion führt (Abbildung 1B) [13].<br />
Programmed cell death protein 1<br />
(PD-1) / Programmed cell death<br />
protein ligand 1 (PD-L1)<br />
Im Gegensatz zu CTLA-4, dessen primäre<br />
Funktion in den ersten Schritten der<br />
T-Zell-Aktivierung liegt, spielt die PD-<br />
1 / PD-L1 Signalachse vor allem im Zielgewebe<br />
der Immunantwort eine zentrale<br />
Rolle bei der Erhaltung der peripheren<br />
Toleranz. Der PD-1-Rezeptor wird vornehmlich<br />
auf aktivierten B- und T-Lymphozyten<br />
exprimiert [14]. Die Expression<br />
Abbildung 1<br />
der Liganden für den PD-1-Rezeptor,<br />
PD-L1 und PD-L2, werden auf einer Vielzahl<br />
von Zelltypen wie Tumorzellen oder<br />
Zellen des Immunsystems exprimiert<br />
und sind auf der Zelloberfläche durch Zytokine<br />
wie Interferon-γ (IFN-γ) induzierbar.<br />
Die physiologische Rolle von PD-1<br />
liegt in der Verhinderung einer prolongierten<br />
Immunantwort bei einer chronischen<br />
Stimulation durch ein Antigen. In<br />
Bezug auf die Tumor-Immunologie geht<br />
man davon aus, dass durch die Expression<br />
von PD-L1 auf der Oberfläche von Tumorzellen<br />
oder auch tumorinfiltrierenden<br />
Immunzellen, diese sich vor den angreifenden<br />
Tumor-spezifischen zytotoxischen<br />
CD8 + T-Lymphozyten schützen<br />
und durch Signalübermittlung via PD-1,<br />
die T-Lymphozyten in einen «schlafenden»<br />
Zustand versetzt werden (Abbildung<br />
1C) [15]. Da im Quervergleich von<br />
klinischen Studien mono klonale Antikörper<br />
gegen PD-1 (z. B. Nivolumab, Pembrolizumab<br />
und Cemiplimab) und gegen<br />
PD-L1 (z.Bsp. Atezolizumab, Durvalumab<br />
und Avelumab) vergleichbare Resultate<br />
erzielten, scheint der zweite Ligand für<br />
PD-1, PD-L2 im Zusammenhang mit Immuntherapien<br />
nur eine untergeordnete<br />
Rolle zu spielen [2]. Die Blockierung von<br />
PD-1 oder auch PD-L1 durch monoklonale<br />
Antikörper verhindert die Inaktivierung<br />
von zuvor in den regionären Lymphknoten<br />
geprimten, tumorspezifischen<br />
T-Lymphozyten im Tumorgewebe (Abbildung<br />
1D).<br />
Immuncheckpoint-Inhibitoren<br />
im klinischen Alltag<br />
Seit der Zulassung des ersten ICI Ipilimumab<br />
für die Behandlung von Patienten mit<br />
metastasiertem Melanom, hat sich die Behandlungslandschaft<br />
in der Onkologie rasant<br />
verändert [16]. Wissenschaftliche Innovation<br />
gepaart mit einer wachsenden<br />
wirtschaftlichen Bedeutung für die pharmazeutische<br />
Industrie führte zu einer<br />
Vielzahl von klinischen Zulassungsstudien<br />
mit unterschiedlichen Antikörpern,<br />
insbesondere zur Blockierung der PD-<br />
1 / PD-L1 Achse, die ein besseres Wirkungsund<br />
günstigeres Nebenwirkungsprofil als<br />
die anti-CTLA-4 Antikörper in der Monotherapie<br />
aufweisen. In der Folge werden<br />
wir einige ausgewählte Tumor-Entitäten<br />
in denen ICI mit Erfolg eingesetzt werden<br />
näher ausführen. In der Übersichts-Tabelle<br />
1 sind die onkologischen Indikationen<br />
und die dafür in der Schweiz und / oder<br />
Europa zugelassenen therapeutischen<br />
Antikörper aufgeführt.<br />
Malignes Melanom<br />
Durch den Einsatz von Ipilimumab konnte<br />
erstmals ein Langzeitüberleben (> 3 Jahre)<br />
für mehr als 20 % der behandelten Patien<br />
ten mit metastasiertem Melanom erzielt<br />
werden, einer Erkrankung, für die in<br />
VSAO /<strong>ASMAC</strong> Journal 1/20 33