Untersuchung des Einflusses von Maservirus auf ... - OPUS Würzburg
Untersuchung des Einflusses von Maservirus auf ... - OPUS Würzburg
Untersuchung des Einflusses von Maservirus auf ... - OPUS Würzburg
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
______________________________- 23 -_____________________________<br />
F-Aktin Bindung<br />
Alphahelikale<br />
Domäne<br />
Aktive „offene“ Form<br />
pThr566<br />
F-<br />
Aktin<br />
PKCθ oder Rho-Kinase<br />
Geschlossene Form<br />
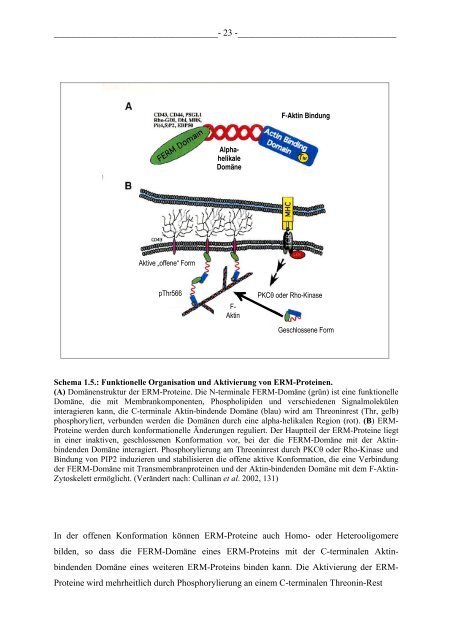
Schema 1.5.: Funktionelle Organisation und Aktivierung <strong>von</strong> ERM-Proteinen.<br />
(A) Domänenstruktur der ERM-Proteine. Die N-terminale FERM-Domäne (grün) ist eine funktionelle<br />
Domäne, die mit Membrankomponenten, Phospholipiden und verschiedenen Signalmolekülen<br />
interagieren kann, die C-terminale Aktin-bindende Domäne (blau) wird am Threoninrest (Thr, gelb)<br />
phosphoryliert, verbunden werden die Domänen durch eine alpha-helikalen Region (rot). (B) ERM-<br />
Proteine werden durch konformationelle Änderungen reguliert. Der Hauptteil der ERM-Proteine liegt<br />
in einer inaktiven, geschlossenen Konformation vor, bei der die FERM-Domäne mit der Aktinbindenden<br />
Domäne interagiert. Phosphorylierung am Threoninrest durch PKCθ oder Rho-Kinase und<br />
Bindung <strong>von</strong> PIP2 induzieren und stabilisieren die offene aktive Konformation, die eine Verbindung<br />
der FERM-Domäne mit Transmembranproteinen und der Aktin-bindenden Domäne mit dem F-Aktin-<br />
Zytoskelett ermöglicht. (Verändert nach: Cullinan et al. 2002, 131)<br />
In der offenen Konformation können ERM-Proteine auch Homo- oder Heterooligomere<br />
bilden, so dass die FERM-Domäne eines ERM-Proteins mit der C-terminalen Aktinbindenden<br />
Domäne eines weiteren ERM-Proteins binden kann. Die Aktivierung der ERM-<br />
Proteine wird mehrheitlich durch Phosphorylierung an einem C-terminalen Threonin-Rest