Erlebnisgastronomie 300 m untertage – das ... - RDB eV
Erlebnisgastronomie 300 m untertage – das ... - RDB eV
Erlebnisgastronomie 300 m untertage – das ... - RDB eV
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Bergbau<br />
die überraschende, oben dargestellte,<br />
Beobachtung erklärt.<br />
Einfluss von<br />
Mikroorganismen<br />
Kohlenmonoxid<br />
verzehrende<br />
Mikroben<br />
Die oben beschriebenen Versuche<br />
wurden bei Luftfeuchtigkeiten<br />
zwischen 0 und 97 %<br />
durchgeführt, <strong>das</strong> heißt an Kohlen,<br />
in denen sich unterschiedliche<br />
Wassergehalte einstellten.<br />
Auf Versuche bei 100 % Luftfeuchtigkeit<br />
wurde zunächst<br />
verzichtet, weil sich dann in den<br />
Kohlen durch Verdunstung und<br />
Kondensation, auch an den Gefäßwänden,<br />
unterschiedliche Gehalte<br />
an freiem flüssigen Wasser ergeben<br />
können.<br />
Um aber doch noch herauszufinden, ob<br />
sich Kohlen mit flüssigem Wasser anders<br />
verhalten als solche mit lediglich adsorbiertem<br />
Wasser, wurden 2 Proben angesetzt,<br />
zu einer ein Schälchen mit gesättigter<br />
Kaliumsulfatlösung mit Bodenkörper<br />
zur Einstellung einer Luftfeuchtigkeit von<br />
97 % gestellt, zu der anderen ein Schälchen<br />
mit reinem Wasser für 100 %. Wie<br />
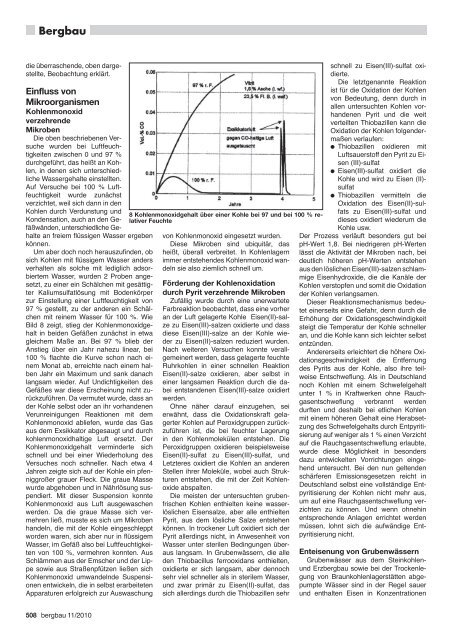
Bild 8 zeigt, stieg der Kohlenmonoxidgehalt<br />
in beiden Gefäßen zunächst in etwa<br />
gleichem Maße an. Bei 97 % blieb der<br />
Anstieg über ein Jahr nahezu linear, bei<br />
100 % flachte die Kurve schon nach einem<br />
Monat ab, erreichte nach einem halben<br />
Jahr ein Maximum und sank danach<br />
langsam wieder. Auf Undichtigkeiten des<br />
Gefäßes war diese Erscheinung nicht zurückzuführen.<br />
Da vermutet wurde, <strong>das</strong>s an<br />
der Kohle selbst oder an ihr vorhandenen<br />
Verunreinigungen Reaktionen mit dem<br />
Kohlenmonoxid abliefen, wurde <strong>das</strong> Gas<br />
aus dem Exsikkator abgesaugt und durch<br />
kohlenmonoxidhaltige Luft ersetzt. Der<br />
Kohlenmonoxidgehalt verminderte sich<br />
schnell und bei einer Wiederholung des<br />
Versuches noch schneller. Nach etwa 4<br />
Jahren zeigte sich auf der Kohle ein pfenniggroßer<br />
grauer Fleck. Die graue Masse<br />
wurde abgehoben und in Nährlösung suspendiert.<br />
Mit dieser Suspension konnte<br />
Kohlenmonoxid aus Luft ausgewaschen<br />
werden. Da die graue Masse sich vermehren<br />
ließ, musste es sich um Mikroben<br />
handeln, die mit der Kohle eingeschleppt<br />
worden waren, sich aber nur in flüssigem<br />
Wasser, im Gefäß also bei Luftfeuchtigkeiten<br />
von 100 %, vermehren konnten. Aus<br />
Schlämmen aus der Emscher und der Lippe<br />
sowie aus Straßenpfützen ließen sich<br />
Kohlenmonoxid umwandelnde Suspensionen<br />
entwickeln, die in selbst erarbeiteten<br />
Apparaturen erfolgreich zur Auswaschung<br />
508 bergbau 11/2010<br />
8 Kohlenmonoxidgehalt über einer Kohle bei 97 und bei 100 % relativer<br />
Feuchte<br />
von Kohlenmonoxid eingesetzt wurden.<br />
Diese Mikroben sind ubiquitär, <strong>das</strong><br />
heißt, überall verbreitet. In Kohlenlagern<br />
immer entstehendes Kohlenmonoxid wandeln<br />
sie also ziemlich schnell um.<br />
Förderung der Kohlenoxidation<br />
durch Pyrit verzehrende Mikroben<br />
Zufällig wurde durch eine unerwartete<br />
Farbreaktion beobachtet, <strong>das</strong>s eine vorher<br />
an der Luft gelagerte Kohle Eisen(II)-salze<br />
zu Eisen(III)-salzen oxidierte und <strong>das</strong>s<br />
diese Eisen(III)-salze an der Kohle wieder<br />
zu Eisen(II)-salzen reduziert wurden.<br />
Nach weiteren Versuchen konnte verallgemeinert<br />
werden, <strong>das</strong>s gelagerte feuchte<br />
Ruhrkohlen in einer schnellen Reaktion<br />
Eisen(II)-salze oxidieren, aber selbst in<br />
einer langsamen Reaktion durch die dabei<br />
entstandenen Eisen(III)-salze oxidiert<br />
werden.<br />
Ohne näher darauf einzugehen, sei<br />
erwähnt, <strong>das</strong>s die Oxidationskraft gelagerter<br />
Kohlen auf Peroxidgruppen zurückzuführen<br />
ist, die bei feuchter Lagerung<br />
in den Kohlenmolekülen entstehen. Die<br />
Peroxidgruppen oxidieren beispielsweise<br />
Eisen(II)-sulfat zu Eisen(III)-sulfat, und<br />
Letzteres oxidiert die Kohlen an anderen<br />
Stellen ihrer Moleküle, wobei auch Strukturen<br />
entstehen, die mit der Zeit Kohlenoxide<br />
abspal ten.<br />
Die meisten der untersuchten grubenfrischen<br />
Kohlen enthielten keine wasserlöslichen<br />
Eisensalze, aber alle enthielten<br />
Pyrit, aus dem lösliche Salze entstehen<br />
können. In trockener Luft oxidiert sich der<br />
Pyrit allerdings nicht, in Anwesen heit von<br />
Wasser unter sterilen Bedingungen überaus<br />
langsam. In Grubenwäs sern, die alle<br />
den Thiobacillus ferrooxidans enthielten,<br />
oxidierte er sich langsam, aber dennoch<br />
sehr viel schneller als in sterilem Wasser,<br />
und zwar primär zu Ei sen(II)-sulfat, <strong>das</strong><br />
sich allerdings durch die Thiobazillen sehr<br />
schnell zu Eisen(III)-sulfat oxidierte.<br />
Die letztgenannte Reaktion<br />
ist für die Oxidation der Kohlen<br />
von Bedeutung, denn durch in<br />
allen untersuchten Kohlen vorhandenen<br />
Pyrit und die weit<br />
verteilten Thiobazillen kann die<br />
Oxidation der Kohlen folgender-<br />
maßen verlaufen:<br />
● Thiobazillen oxidieren mit<br />
Luftsauerstoff den Pyrit zu Eisen<br />
(III)-sulfat<br />
● Eisen(III)-sulfat oxidiert die<br />
Kohle und wird zu Eisen (II)sulfat<br />
● Thiobazillen vermitteln die<br />
Oxidation des Eisen(II)-sulfats<br />
zu Eisen(III)-sulfat und<br />
dieses oxidiert wiederum die<br />
Kohle usw.<br />
Der Prozess verläuft besonders gut bei<br />
pH-Wert 1,8. Bei niedrigeren pH-Werten<br />
lässt die Aktivität der Mikroben nach, bei<br />
deutlich höheren pH-Werten entstehen<br />
aus den löslichen Eisen(III)-salzen schlammige<br />
Eisenhydroxide, die die Kanäle der<br />
Kohlen verstopfen und somit die Oxidation<br />
der Kohlen verlangsamen.<br />
Dieser Reaktionsmechanismus bedeutet<br />
einerseits eine Gefahr, denn durch die<br />
Erhöhung der Oxidationsgeschwindigkeit<br />
steigt die Temperatur der Kohle schneller<br />
an, und die Kohle kann sich leichter selbst<br />
entzünden.<br />
Andererseits erleichtert die höhere Oxidationsgeschwindigkeit<br />
die Entfernung<br />
des Pyrits aus der Kohle, also ihre teilweise<br />
Entschweflung. Als in Deutschland<br />
noch Kohlen mit einem Schwefelgehalt<br />
unter 1 % in Kraftwerken ohne Rauchgasentschwef<br />
lung verbrannt werden<br />
durften und deshalb bei etlichen Kohlen<br />
mit einem höhe ren Gehalt eine Herabsetzung<br />
des Schwefelgehalts durch Entpyritisierung<br />
auf weniger als 1 % einen Verzicht<br />
auf die Rauchgasentschweflung er laubte,<br />
wurde diese Möglichkeit in besonders<br />
dazu entwickelten Vorrichtungen eingehend<br />
untersucht. Bei den nun geltenden<br />
schärferen Emissionsgeset zen reicht in<br />
Deutschland selbst eine vollständige Entpyritisierung<br />
der Kohlen nicht mehr aus,<br />
um auf eine Rauchgasentschweflung verzichten<br />
zu können. Und wenn ohnehin<br />
entsprechende Anlagen errichtet werden<br />
müssen, lohnt sich die aufwändige Entpyritisierung<br />
nicht.<br />
Enteisenung von Grubenwässern<br />
Grubenwässer aus dem Steinkohlen-<br />
und Erzbergbau sowie bei der Trockenlegung<br />
von Braunkohlenlagerstätten abgepumpte<br />
Wässer sind in der Regel sauer<br />
und enthalten Eisen in Konzentrationen