Querschnitt 21 / Februar 2007 - h_da: Hochschule Darmstadt
Querschnitt 21 / Februar 2007 - h_da: Hochschule Darmstadt
Querschnitt 21 / Februar 2007 - h_da: Hochschule Darmstadt
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Querschnitt</strong> <strong>21</strong><br />
60000<br />
50000<br />
40000<br />
30000<br />
20000<br />
10000<br />
RFU<br />
0 2000 4000 6000 8000 10000<br />
12000<br />
Zeit (s)<br />
Abbildung 4b • Messung des Sauerstoffverbrauchs von Escherichia coli unter Einfluss von DMSO in folgender Konzentration:<br />
0,01 ( ) 0,05 ( ) 0,1 ( ) 0,5 ( ) 1 ( ) und 1,5 ( ) % (v/v). Die Zellkonzentration betrug 0,48 x 10 7 Zellen pro Kavität. Angabe in relativen Fluoreszenzeinheiten (RFU).<br />
erklärt sich durch langsam durch die Paraffinschicht nachdiffundieren<br />
den Luftsauerstoff. Des Weiteren zeigt sich eine<br />
starke Verzögerung im Sauerstoffverbrauch aller mit DMSO<br />
behandelten Kulturen im Gegensatz zur Kontrolle. Die Stärke<br />
der Verzögerung ist aber nicht abhängig von der Konzentration.<br />
Penicillin zeigt in niedrigen Konzentrationen unter 100<br />
µM Merkmale eines Bakteriostatikums. Die Fluoreszenz zeigt<br />
ähnlich hohe Werte wie die Kontrolle und der Sauerstoffverbrauch<br />
erfolgt leicht verzögert. Ab einer Konzentration von<br />
0,5 mM fällt jedoch der maximale Signalwert ab. Hier machen<br />
sich die Destabilisierung der Zellmembran und die <strong>da</strong>durch<br />
erfolgte Zelllyse bemerkbar.<br />
5 • Vergleich mit anderen methoden<br />
Traditionell werden Sauerstoffmessungen mittels der Clarkelektrode<br />
durchgeführt. Diese verbraucht Sauerstoff nach folgender<br />
elektrochemischer reaktion:<br />
pt-kathode o + e - + h + h o<br />
ag-anode ag + cl - agcl + e -<br />
Bei dieser reaktion kann ein Strom gemessen werden, der der<br />
Sauerstoffkonzentration proportional ist. Clark-elektroden haben<br />
einige systembedingte Nachteile:<br />
Da diese reaktion Sauerstoff verbraucht, würde <strong>da</strong>s Messergebnis<br />
in den hier benötigten kleinen Volumina verfälscht<br />
werden. Durch den hohen apparativen Aufwand sind nur sequentielle<br />
Messungen möglich, was die Methode für Hochdurchsatz-Substanztestungen<br />
ungeeignet macht. Da es sich<br />
um eine invasive Messung handelt, kann die elektrode durch<br />
0<br />
die im zu messenden Medium enthaltenen Stoffe, wie z. B. H 2 S,<br />
vergiftet werden. um repräsentative Messwerte zu erhalten, ist<br />
es zudem notwendig, die elektrode in definierter Weise anzuströmen.<br />
Außerdem können im Medium enthaltene Feststoffe<br />
die elektrode verstopfen und so die Messung verfälschen. ein<br />
Problem <strong>da</strong>s beispielsweise in Kläranlagen auftritt.<br />
Der fluoreszenzbasierte Sauerstoffsensor bietet aber nicht nur<br />
im Vergleich mit klassischen Methoden der Sauerstoffmessung,<br />
sondern gerade auch im Hinblick auf die Messung der<br />
antimikrobiellen Aktivität Vorteile. Zur Messung der antimikrobiellen<br />
Aktivität von Wirkstoffen, wie z. B. Antibiotika, wird üblicherweise<br />
die so genannte minimale Hemmkonzentration mit<br />
der „tube dilution technique“ bestimmt [1]. Dazu wird Medium<br />
mit unterschiedlichen Antibiotikakonzentrationen in eine reihe<br />
von reagenzgläsern gegeben und mit einer Bakterienkultur<br />
angeimpft. Die Kulturen werden über Nacht inkubiert und die<br />
reagenzgläser in denen kein Wachstum auftritt erfasst und so<br />
die Minimale Hemmkonzentration (MHK) bestimmt.<br />
eine alternative Methode zur Bestimmung antimikrobieller Aktivität<br />
ist die so genannte „agar diffusion method“ [1]. Dazu wird<br />
ein Agar-Nährboden gleichmäßig mit der Testkultur inokuliert.<br />
Auf Filterpapierscheiben werden definierte Mengen des Antibiotikums<br />
aufgegeben und die Papiere werden auf die Agar-<br />
oberfläche gelegt. Die Agarplatten werden inkubiert. Währenddessen<br />
diffundiert <strong>da</strong>s Antibiotikum in den Agar. Je weiter<br />
es diffundiert, desto geringer ist seine Konzentration an dieser<br />
Stelle. Dabei wird an einer Stelle die MHK erreicht. Oberhalb<br />
dieser Konzentration wird <strong>da</strong>s Wachstum der Mikroorganismen<br />
gehemmt. Nach der MHK wachsen die Mikroorganismen weiterhin.<br />
Nach der Inkubationszeit kann man so Hemmhöfe um<br />
Verwendung fluoreszenzbasierter sauerstoffsensoren zur unterscheidung bakterizider und bakteriostatischer substanzen<br />
<strong>da</strong>s Filterpapier erkennen, in denen kein Wachstum stattfand.<br />
Deren Durchmesser ist proportional zur aufgegebenen Antibiotikamenge.<br />
Beide Methoden zur Bestimmung der antimikrobiellen<br />
Aktivität erfordern lange Inkubationszeiten, meist über<br />
Nacht. Außerdem können durch den erforderlichen Aufwand<br />
nur wenige Proben auf einmal gemessen werden.<br />
Die hier vorgestellten fluoreszenzbasierten Sensoren sind<br />
im Gegensatz zu Clark-elektroden auch in kleinen Volumina<br />
einsetzbar und so insbesondere zur Messung des Sauerstoff-<br />
Verbrauchs von Bakterien geeignet. Sie können nicht-invasiv<br />
eingesetzt werden, somit ist die Messung unabhängig von der<br />
Zusammensetzung des Mediums. Im Gegensatz zu etablierten<br />
Methoden zur Bestimmung der Wirksamkeit von Antibiotika,<br />
ermöglichen die fluoreszenzbasierten Sensoren in Mikrotestplatten<br />
die Bestimmung von Dosiswirkungskurven von Wirkstoffen<br />
in erheblich kürzerer Zeit. Außerdem kann ein sehr<br />
hoher Probendurchsatz erreicht werden, weil bis zu 96 Proben<br />
parallel bestimmt werden können. Möglicherweise lässt sich<br />
der Sensor auch auf 384-Mikrotestplatten etablieren, was in<br />
Kombination mit automatischen Pipettierstationen den Durchsatz<br />
weiter erhöhen würde.<br />
6 • Fazit und Ausblick<br />
In diesem Bericht wird die Herstellung, Qualitätskontrolle und<br />
Verwendung eines fluoreszenzbasierten Sensors zur untersuchung<br />
des Sauerstoff-Verbrauchs von Bakterienkulturen<br />
beschrieben. Der steigende einsatz von Tests mit pro- oder eukaryontischen<br />
Zellen, fordert immer effizientere und kostengünstigere<br />
Assays, mit denen Bakterienkulturen untersucht<br />
werden können. Die Verwendung fluoreszenzbasierter Sensoren<br />
kann diese Anforderungen erfüllen. So ist die Herstellung<br />
der Sensoren einfach und kostengünstig. Ferner konnten die<br />
Wirkungen von Antibiotika nachgewiesen werden. es konnte<br />
<strong>da</strong>rüber hinaus gezeigt werden, <strong>da</strong>ss sich bakteriostatisch und<br />
bakterizid wirksame Antibiotika durch 3 – 4-stündige Sauerstoffverbrauchs-Kinetiken<br />
unterscheiden lassen. Damit könnten<br />
nicht nur individuelle Antibiogramme von Patienten noch<br />
schneller als mit herkömmlichen Methoden erstellt werden,<br />
sondern auch neue Antibiotika hinsichtlich ihres Wirkmechanismus<br />
charakterisiert werden. Aber auch viele andere Sub-<br />
stanzen können auf ihre Toxizität hin untersucht werden. Vorstellbar<br />
ist auch, Atmungsgifte in ihren effekten durch den<br />
Sensor voneinander zu unterscheiden. Die einfache Herstellung<br />
und Benutzung machen den Sensor für viele Bereiche, in<br />
denen Sauerstoff gemessen wird, attraktiv. eine Anwendung<br />
könnte <strong>da</strong>s Monitoring des Sauerstoffgehalts einer Fermentationslösung<br />
in einem Bioreaktor <strong>da</strong>rstellen.<br />
Hierbei ist gerade von Bedeutung, <strong>da</strong>ss der Sensor nicht invasiv<br />
eingesetzt werden muss, wie die Clark-elektrode. Dieser<br />
Vorteil macht den Sensor auch für die Anwendung in Kläranlagen<br />
interessant. Auch in Biogasanlagen wäre ein einsatz des<br />
Sensors möglich. Hier ist es notwendig, den restsauerstoff im<br />
Gasgemisch unter 2 – 3 % zu halten, <strong>da</strong> zum einen der Brennwert<br />
des Gases sonst zu niedrig ist. Zum anderen reagiert der<br />
bei der reaktion anfallende Schwefelwasserstoff mit Sauerstoff<br />
zu Schwefelsäure. Der Sensor bietet den Vorteil, <strong>da</strong>ss er<br />
gerade bei niedrigen Sauerstoffkonzentrationen sensitiv ist,<br />
außerdem kann er im Gegensatz zur Clark-elektrode nicht<br />
durch Schwefelwasserstoff vergiftet werden.<br />
Der Sensor kann weiterhin nicht nur für Toxizitätstest mit Mikroorganismen<br />
eingesetzt werden, sondern auch für Tests mit<br />
80000<br />
60000<br />
40000<br />
20000<br />
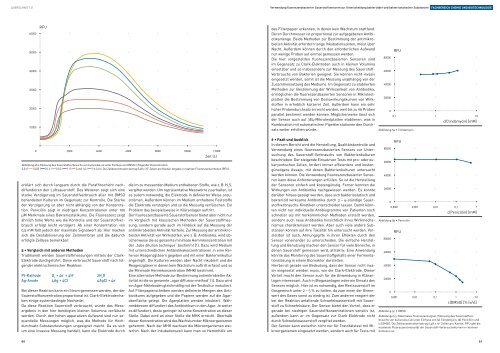
Abbildung 5a • Clin<strong>da</strong>mycin<br />
80000<br />
60000<br />
40000<br />
20000<br />
RFU<br />
0<br />
0,0001 0,001 0,01 0,1 1<br />
Abbildung 5b • Penicillin<br />
80000<br />
60000<br />
40000<br />
20000<br />
RFU<br />
RFU<br />
FAchbereich chemie und biotechnologie<br />
0<br />
0,1 1 10<br />
c(Clin<strong>da</strong>mycin) [mM]<br />
c(Penicillin) [mM]<br />
0<br />
0,001 0,01 0,1 1 10<br />
c(DMSO) [% (v/v)]<br />
Abbildung 5c • DMSO<br />
Abbildungen 5: Maximales Fluoreszenzsignal | Messung des Sauerstoffverbrauchs<br />
von Escherichia Coli unter einfluss von (a) Clin<strong>da</strong>mycin, (b) Penicillin und<br />
(c) DMSO. Die Zellkonzentration betrug 0,48 x 107 Zellen pro Kavität. rFu gibt die<br />
maximale Fluoreszenzintensität der Sauerstoff-Verbrauchskurven in relativen<br />
einheiten an.<br />
1