CAPÍTULO 5. Termodinámica - Biblioteca
CAPÍTULO 5. Termodinámica - Biblioteca
CAPÍTULO 5. Termodinámica - Biblioteca
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Calor y <strong>Termodinámica</strong> Hugo Medina Guzmán<br />
Expresión que nos permite al integrarla, calcular e<br />
trabajo entre dos estados, conociendo la relación<br />
entre la presión y el volumen.<br />
W<br />
A→B<br />
=<br />
∫<br />
B<br />
A<br />
pdV<br />
Ejemplo 76. En cierto cilindro un émbolo móvil<br />
encierra un volumen Vo con presión po. El émbolo se<br />
deja libre. ¿Qué trabajo ejecutará el gas sobre el<br />
émbolo?, si el volumen del gas, al desplazarse el<br />
émbolo, aumenta al doble, en tanto que la presión<br />
del gas en este caso:<br />
a) permanece constante;<br />
b) crece linealmente hasta la presión 2po a medida<br />
que aumenta el volumen.<br />
Solución.<br />
a) p = constante<br />
W = ∫ pdV ⇒<br />
2Vo 2V0<br />
W = po<br />
∫ dV = poV<br />
V<br />
V<br />
o<br />
0<br />
0 2V −V<br />
p V<br />
W = p =<br />
= ( 0 0 ) 0 0<br />
b) El gráfico muestra la relación lineal de la presión<br />
y la temperatura.<br />
p − p0<br />
V −V<br />
W =<br />
=<br />
∫<br />
0<br />
2V<br />
2 p0<br />
− p<br />
=<br />
2V0<br />
−V<br />
0 p0<br />
VdV<br />
V<br />
0<br />
0<br />
p<br />
=<br />
V<br />
V0<br />
0<br />
2<br />
2V0<br />
p0<br />
V<br />
V0<br />
2 V0<br />
0<br />
p0<br />
=<br />
2V0<br />
4<br />
3<br />
= p0V 2<br />
0<br />
0<br />
p0<br />
⇒ p = V<br />
V<br />
2 2 ( V −V<br />
)<br />
PRIMERA LEY DE LA TERMODINÁMICA.<br />
Como ya hemos dicho la transferencia de calor y la<br />
realización de trabajo constituyen dos formas o<br />
métodos de transferir, suministrar o quitar, energía a<br />
una sustancia, o sea, representa energía en tránsito y<br />
son los términos utilizados cuando la energía está en<br />
movimiento. Una vez que la transferencia de<br />
0<br />
0<br />
0<br />
38<br />
energía termina se dice que el sistema ha<br />
experimentado un cambio de energía interna.<br />
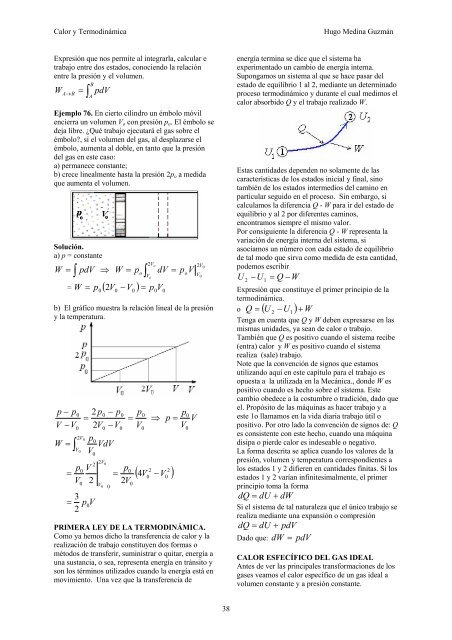
Supongamos un sistema al que se hace pasar del<br />
estado de equilibrio 1 al 2, mediante un determinado<br />
proceso termodinámico y durante el cual medimos el<br />
calor absorbido Q y el trabajo realizado W.<br />
Estas cantidades dependen no solamente de las<br />
características de los estados inicial y final, sino<br />
también de los estados intermedios del camino en<br />
particular seguido en el proceso. Sin embargo, si<br />
calculamos la diferencia Q - W para ir del estado de<br />
equilibrio y al 2 por diferentes caminos,<br />
encontramos siempre el mismo valor.<br />
Por consiguiente la diferencia Q - W representa la<br />
variación de energía interna del sistema, si<br />
asociamos un número con cada estado de equilibrio<br />
de tal modo que sirva como medida de esta cantidad,<br />
podemos escribir<br />
U 2 −U 1 = Q −W<br />
Expresión que constituye el primer principio de la<br />
termodinámica.<br />
o Q = ( U 2 −U<br />
1 ) + W<br />
Tenga en cuenta que Q y W deben expresarse en las<br />
mismas unidades, ya sean de calor o trabajo.<br />
También que Q es positivo cuando el sistema recibe<br />
(entra) calor y W es positivo cuando el sistema<br />
realiza (sale) trabajo.<br />
Note que la convención de signos que estamos<br />
utilizando aquí en este capítulo para el trabajo es<br />
opuesta a la utilizada en la Mecánica., donde W es<br />
positivo cuando es hecho sobre el sistema. Este<br />
cambio obedece a la costumbre o tradición, dado que<br />
el. Propósito de las máquinas as hacer trabajo y a<br />
este 1o llamamos en la vida diaria trabajo útil o<br />
positivo. Por otro lado la convención de signos de: Q<br />
es consistente con este hecho, cuando una máquina<br />
disipa o pierde calor es indeseable o negativo.<br />
La forma descrita se aplica cuando los valores de la<br />
presión, volumen y temperatura correspondientes a<br />
los estados 1 y 2 difieren en cantidades finitas. Si los<br />
estados 1 y 2 varían infinitesimalmente, el primer<br />
principio toma la forma<br />
dQ = dU + dW<br />
Si el sistema de tal naturaleza que el único trabajo se<br />
realiza mediante una expansión o compresión<br />
dQ = dU + pdV<br />
dW =<br />
Dado que: pdV<br />
CALOR ESFECÍFICO DEL GAS IDEAL<br />
Antes de ver las principales transformaciones de los<br />
gases veamos el calor específico de un gas ideal a<br />
volumen constante y a presión constante.