memoria-2014
memoria-2014
memoria-2014
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
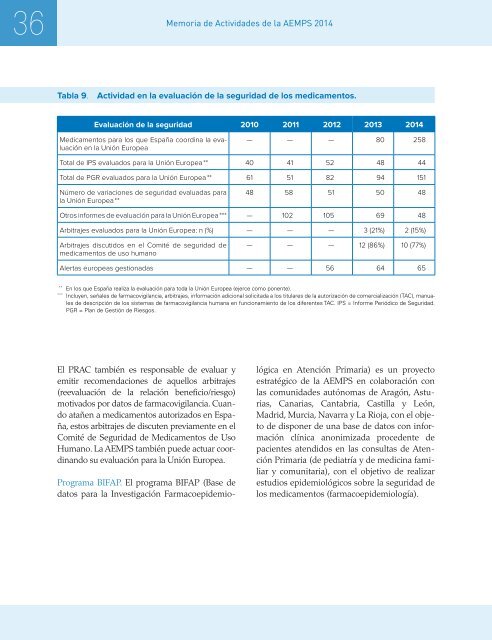
36Memoria de Actividades de la AEMPS <strong>2014</strong>Tabla 9. Actividad en la evaluación de la seguridad de los medicamentos.Evaluación de la seguridad 2010 2011 2012 2013 <strong>2014</strong>Medicamentos para los que España coordina la evaluaciónen la Unión Europea— — — 80 258Total de IPS evaluados para la Unión Europea ** 40 41 52 48 44Total de PGR evaluados para la Unión Europea ** 61 51 82 94 151Número de variaciones de seguridad evaluadas parala Unión Europea **48 58 51 50 48Otros informes de evaluación para la Unión Europea *** — 102 105 69 48Arbitrajes evaluados para la Unión Europea: n (%) — — — 3 (21%) 2 (15%)Arbitrajes discutidos en el Comité de seguridad demedicamentos de uso humano— — — 12 (86%) 10 (77%)Alertas europeas gestionadas — — 56 64 65**En los que España realiza la evaluación para toda la Unión Europea (ejerce como ponente).***Incluyen, señales de farmacovigilancia, arbitrajes, información adicional solicitada a los titulares de la autorización de comercialización (TAC), manualesde descripción de los sistemas de farmacovigilancia humana en funcionamiento de los diferentes TAC. IPS = Informe Periódico de Seguridad.PGR = Plan de Gestión de Riesgos.El PRAC también es responsable de evaluar yemitir recomendaciones de aquellos arbitrajes(reevaluación de la relación beneficio/riesgo)motivados por datos de farmacovigilancia. Cuandoatañen a medicamentos autorizados en España,estos arbitrajes de discuten previamente en elComité de Seguridad de Medicamentos de UsoHumano. La AEMPS también puede actuar coordinandosu evaluación para la Unión Europea.Programa BIFAP. El programa BIFAP (Base dedatos para la Investigación Farmacoepidemiológicaen Atención Primaria) es un proyectoestratégico de la AEMPS en colaboración conlas comunidades autónomas de Aragón, Asturias,Canarias, Cantabria, Castilla y León,Madrid, Murcia, Navarra y La Rioja, con el objetode disponer de una base de datos con informaciónclínica anonimizada procedente depacientes atendidos en las consultas de AtenciónPrimaria (de pediatría y de medicina familiary comunitaria), con el objetivo de realizarestudios epidemiológicos sobre la seguridad delos medicamentos (farmacoepidemiología).