4-2021
Fachzeitschrift für Medizintechnik-Produktion, Entwicklung, Distribution und Qualitätsmanagement
Fachzeitschrift für Medizintechnik-Produktion, Entwicklung, Distribution und Qualitätsmanagement
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Medical Device Regulation<br />
Geltungsbeginn der MDR – Alles neu bei der<br />
Produktion von Medizinprodukten?<br />
Neue Anforderungen an<br />
die Produkte und an die<br />
Produktion?<br />
Autor:<br />
Hans-Peter Bursig,<br />
ZVEI-Fachverbandsgeschäftsführer<br />
Elektromedizinische Technik<br />
www.zvei.org/gesundheit<br />
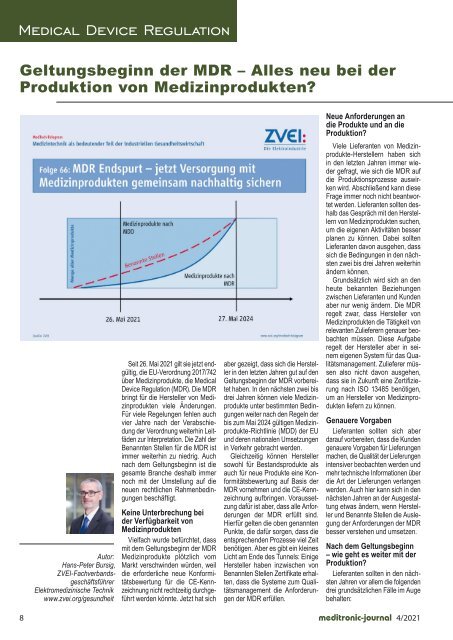
Seit 26. Mai <strong>2021</strong> gilt sie jetzt endgültig,<br />
die EU-Verordnung 2017/742<br />
über Medizinprodukte, die Medical<br />
Device Regulation (MDR). Die MDR<br />
bringt für die Hersteller von Medizinprodukten<br />
viele Änderungen.<br />
Für viele Regelungen fehlen auch<br />
vier Jahre nach der Verabschiedung<br />
der Verordnung weiterhin Leitfäden<br />
zur Interpretation. Die Zahl der<br />
Benannten Stellen für die MDR ist<br />
immer weiterhin zu niedrig. Auch<br />
nach dem Geltungsbeginn ist die<br />
gesamte Branche deshalb immer<br />
noch mit der Umstellung auf die<br />
neuen rechtlichen Rahmenbedingungen<br />
beschäftigt.<br />
Keine Unterbrechung bei<br />
der Verfügbarkeit von<br />
Medizinprodukten<br />
Vielfach wurde befürchtet, dass<br />
mit dem Geltungsbeginn der MDR<br />
Medizinprodukte plötzlich vom<br />
Markt verschwinden würden, weil<br />
die erforderliche neue Konformitätsbewertung<br />
für die CE-Kennzeichnung<br />
nicht rechtzeitig durchgeführt<br />
werden könnte. Jetzt hat sich<br />
aber gezeigt, dass sich die Hersteller<br />
in den letzten Jahren gut auf den<br />
Geltungsbeginn der MDR vorbereitet<br />
haben. In den nächsten zwei bis<br />
drei Jahren können viele Medizinprodukte<br />
unter bestimmten Bedingungen<br />
weiter nach den Regeln der<br />
bis zum Mai 2024 gültigen Medizinprodukte-Richtlinie<br />
(MDD) der EU<br />
und deren nationalen Umsetzungen<br />
in Verkehr gebracht werden.<br />
Gleichzeitig können Hersteller<br />
sowohl für Bestandsprodukte als<br />
auch für neue Produkte eine Konformitätsbewertung<br />
auf Basis der<br />
MDR vornehmen und die CE-Kennzeichnung<br />
aufbringen. Voraussetzung<br />
dafür ist aber, dass alle Anforderungen<br />
der MDR erfüllt sind.<br />
Hierfür gelten die oben genannten<br />
Punkte, die dafür sorgen, dass die<br />
entsprechenden Prozesse viel Zeit<br />
benötigen. Aber es gibt ein kleines<br />
Licht am Ende des Tunnels: Einige<br />
Hersteller haben inzwischen von<br />
Benannten Stellen Zertifikate erhalten,<br />
dass die Systeme zum Qualitätsmanagement<br />
die Anforderungen<br />
der MDR erfüllen.<br />
Viele Lieferanten von Medizinprodukte-Herstellern<br />
haben sich<br />
in den letzten Jahren immer wieder<br />
gefragt, wie sich die MDR auf<br />
die Produktionsprozesse auswirken<br />
wird. Abschließend kann diese<br />
Frage immer noch nicht beantwortet<br />
werden. Lieferanten sollten deshalb<br />
das Gespräch mit den Herstellern<br />
von Medizinprodukten suchen,<br />
um die eigenen Aktivitäten besser<br />
planen zu können. Dabei sollten<br />
Lieferanten davon ausgehen, dass<br />
sich die Bedingungen in den nächsten<br />
zwei bis drei Jahren weiterhin<br />
ändern können.<br />
Grundsätzlich wird sich an den<br />
heute bekannten Beziehungen<br />
zwischen Lieferanten und Kunden<br />
aber nur wenig ändern. Die MDR<br />
regelt zwar, dass Hersteller von<br />
Medizinprodukten die Tätigkeit von<br />
relevanten Zulieferern genauer beobachten<br />
müssen. Diese Aufgabe<br />
regelt der Hersteller aber in seinem<br />
eigenen System für das Qualitätsmanagement.<br />
Zulieferer müssen<br />
also nicht davon ausgehen,<br />
dass sie in Zukunft eine Zertifizierung<br />
nach ISO 13485 benötigen,<br />
um an Hersteller von Medizinprodukten<br />
liefern zu können.<br />
Genauere Vorgaben<br />
Lieferanten sollten sich aber<br />
darauf vorbereiten, dass die Kunden<br />
genauere Vorgaben für Lieferungen<br />
machen, die Qualität der Lieferungen<br />
intensiver beobachten werden und<br />
mehr technische Informationen über<br />
die Art der Lieferungen verlangen<br />
werden. Auch hier kann sich in den<br />
nächsten Jahren an der Ausgestaltung<br />
etwas ändern, wenn Hersteller<br />
und Benannte Stellen die Auslegung<br />
der Anforderungen der MDR<br />
besser verstehen und umsetzen.<br />
Nach dem Geltungsbeginn<br />
– wie geht es weiter mit der<br />
Produktion?<br />
Lieferanten sollten in den nächsten<br />
Jahren vor allem die folgenden<br />
drei grundsätzlichen Fälle im Auge<br />
behalten:<br />
8 meditronic-journal 4/<strong>2021</strong>