ser usada para separar IgM. Cuando se requiere obtener una preparación pura de IgM, sepuede utilizar esta técnica combinada con la precipitación con sulfato de amonio.Cromatografía de Intercambio IónicoFundamentos:<strong>La</strong> cromatografía de intercambio iónico trabaja mediante la unión de biomoléculas con unacarga determinada, a una matriz estacionaria de carga opuesta.<strong>La</strong>s biomoléculas se unen a resinas de intercambio iónico cuando tienen carga opuesta a la delos iones fijos de la resina. Esta unión es de tipo electrostático y reversible: <strong>La</strong> fuerza de estaunión puede ser modificada variando la concentración salina y el pH de la solución bufferutilizada como eluyente.<strong>La</strong> separación de dos o más sustancias mediante la utilización de resinas de intercambioiónico se consigue por un mecanismo de adsorción reversible, que consiste en la fijación inicialy posterior remoción de tales sustancias a una resina estabilizada. Si las sustancias fijadastienen diferentes propiedades eléctricas, mediante la variación del pH o fuerza iónica deleluyente se conseguirá que cada una de ellas eluya por separado.Matrices y solventes:<strong>La</strong> matriz puede estar constituida por silicato de aluminio, resinas sintéticas, polisacáridoscomo la celulosa o el dextrano, etc. <strong>La</strong> naturaleza de los grupos cargados es la que determinael tipo y la fuerza de unión del ión intercambiador. Los dos tipos de resinas más utilizadas son: de intercambio catiónico (con matrices con carga negativa) y de intercambio aniónico (con matrices con carga positiva).<strong>La</strong> elección correcta de la resina, en especial en lo que se refiere al grupo funcional que leaporta la carga, dependerá de la carga neta de la sustancia que se desea separar.En los casos de moléculas anfotéricas como las proteínas, que poseen grupos cargadospositiva y negativamente, su carga neta dependerá del pH del medio. Estas sustancias, segúnsea el pH del medio, podrán unirse a resinas aniónicas o catiónicas; en su punto isoeléctrico(pI), tendrán carga neta cero y no se fijarán a ningún tipo de resina intercambiadora. Cromatografía de AfinidadFundamentos:<strong>La</strong> técnica de cromatografía de afinidad es una de las técnicas más utilizadas para lapurificación de proteínas. Consiste en una cromatografía de adsorción en la que se aprovechala especificidad de interacciones biológicas como las interacciones antígeno-anticuerpo,enzima-inhibidor, hormona-receptor, lectina-hidrato de carbono, etc. <strong>La</strong> biomolécula que sequiere purificar (por ejemplo, un anticuerpo) usualmente tiene un sitio de reconocimiento através del cual puede interactuar con otra molécula natural o artificial a la que se llama ligando.El ligando es inmovilizado sobre una matriz polimérica y es usado para capturar selectivamentea la biomolécula que se desea purificar, cuando ésta se encuentra en una mezcla impura. <strong>La</strong>biomolécula deseada puede ser eluída del ligando por cambios en las condiciones externas(pH, fuerza iónica, solventes y temperatura) que desestabilizan la interacción biomolécula–ligando y permiten que la molécula deseada sea eluida en forma purificada.Existe una gran diversidad de biomoléculas que pueden purificarse por este métodocromatográfico, entre ellas: antígenos, anticuerpos, enzimas, proteínas unidas a hormonas,proteínas unidas a vitaminas, receptores, glicoproteínas, lectinas, ARN, ADN, bacterias, virus,fagos, células y proteínas producidas por ingeniería genética.<strong>La</strong> naturaleza de la matriz a la que se fijan los ligandos es muy importante, ya que en lascondiciones experimentales debe ser física y químicamente estable, no debe actuar comotamiz molecular y debe asegurar un buen flujo durante la elución.Existen numerosas matrices comerciales disponibles en su forma activada o sin activar paraser utilizadas como soporte para el ligando. <strong>La</strong> activación de la matriz se realiza para que el30
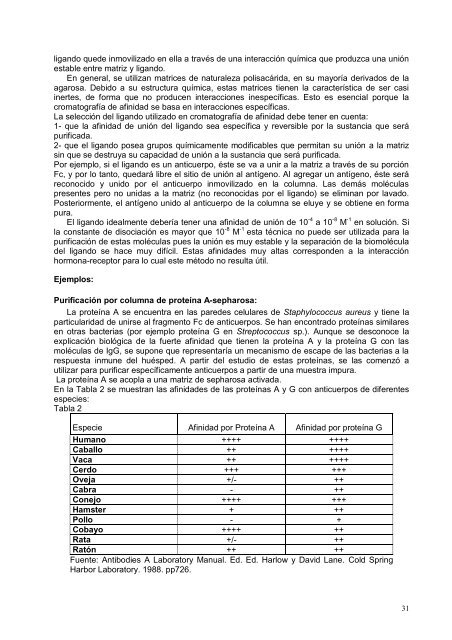
ligando quede inmovilizado en ella a través de una interacción química que produzca una uniónestable entre matriz y ligando.En general, se utilizan matrices de naturaleza polisacárida, en su mayoría derivados de laagarosa. Debido a su estructura química, estas matrices tienen la característica de ser casiinertes, de forma que no producen interacciones inespecíficas. Esto es esencial porque lacromatografía de afinidad se basa en interacciones específicas.<strong>La</strong> selección del ligando utilizado en cromatografía de afinidad debe tener en cuenta:1- que la afinidad de unión del ligando sea específica y reversible por la sustancia que serápurificada.2- que el ligando posea grupos químicamente modificables que permitan su unión a la matrizsin que se destruya su capacidad de unión a la sustancia que será purificada.Por ejemplo, si el ligando es un anticuerpo, éste se va a unir a la matriz a través de su porciónFc, y por lo tanto, quedará libre el sitio de unión al antígeno. Al agregar un antígeno, éste seráreconocido y unido por el anticuerpo inmovilizado en la columna. <strong>La</strong>s demás moléculaspresentes pero no unidas a la matriz (no reconocidas por el ligando) se eliminan por lavado.Posteriormente, el antígeno unido al anticuerpo de la columna se eluye y se obtiene en formapura.El ligando idealmente debería tener una afinidad de unión de 10 -4 a 10 -8 M -1 en solución. Sila constante de disociación es mayor que 10 -8 M -1 esta técnica no puede ser utilizada para lapurificación de estas moléculas pues la unión es muy estable y la separación de la biomoléculadel ligando se hace muy difícil. Estas afinidades muy altas corresponden a la interacciónhormona-receptor para lo cual este método no resulta útil.Ejemplos:Purificación por columna de proteína A-sepharosa:<strong>La</strong> proteína A se encuentra en las paredes celulares de Staphylococcus aureus y tiene laparticularidad de unirse al fragmento Fc de anticuerpos. Se han encontrado proteínas similaresen otras bacterias (por ejemplo proteína G en Streptococcus sp.). Aunque se desconoce laexplicación biológica de la fuerte afinidad que tienen la proteína A y la proteína G con lasmoléculas de IgG, se supone que representaría un mecanismo de escape de las bacterias a larespuesta inmune del huésped. A partir del estudio de estas proteínas, se las comenzó autilizar para purificar específicamente anticuerpos a partir de una muestra impura.<strong>La</strong> proteína A se acopla a una matriz de sepharosa activada.En la Tabla 2 se muestran las afinidades de las proteínas A y G con anticuerpos de diferentesespecies:Tabla 2Especie Afinidad por Proteína A Afinidad por proteína GHumano ++++ ++++Caballo ++ ++++Vaca ++ ++++Cerdo +++ +++Oveja +/- ++Cabra - ++Conejo ++++ +++Hamster + ++Pollo - +Cobayo ++++ ++Rata +/- ++Ratón ++ ++Fuente: Antibodies A <strong>La</strong>boratory Manual. Ed. Ed. Harlow y David <strong>La</strong>ne. Cold SpringHarbor <strong>La</strong>boratory. 1988. pp726.31