INMUNOLOGÃA BÃSICA â CURSADA 2012 La InmunologÃa estudia ...
INMUNOLOGÃA BÃSICA â CURSADA 2012 La InmunologÃa estudia ...
INMUNOLOGÃA BÃSICA â CURSADA 2012 La InmunologÃa estudia ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
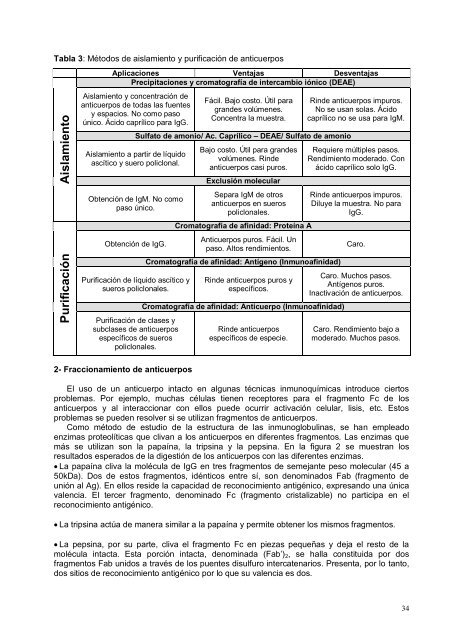
Tabla 3: Métodos de aislamiento y purificación de anticuerposAislamientoPurificaciónAplicaciones Ventajas DesventajasPrecipitaciones y cromatografía de intercambio iónico (DEAE)Aislamiento y concentración deanticuerpos de todas las fuentesy espacios. No como pasoúnico. Ácido caprílico para IgG.Fácil. Bajo costo. Útil paragrandes volúmenes.Concentra la muestra.Sulfato de amonio/ Ac. Caprílico – DEAE/ Sulfato de amonioAislamiento a partir de líquidoascítico y suero policlonal.Obtención de IgM. No comopaso único.Obtención de IgG.Purificación de líquido ascítico ysueros policlonales.Purificación de clases ysubclases de anticuerposespecíficos de suerospoliclonales.Bajo costo. Útil para grandesvolúmenes. Rindeanticuerpos casi puros.Exclusión molecularSepara IgM de otrosanticuerpos en suerospoliclonales.Cromatografía de afinidad: Proteína AAnticuerpos puros. Fácil. Unpaso. Altos rendimientos.Cromatografía de afinidad: Antígeno (Inmunoafinidad)Rinde anticuerpos puros yespecíficos.Cromatografía de afinidad: Anticuerpo (Inmunoafinidad)Rinde anticuerposespecíficos de especie.Rinde anticuerpos impuros.No se usan solas. Ácidocaprílico no se usa para IgM.Requiere múltiples pasos.Rendimiento moderado. Conácido caprílico solo IgG.Rinde anticuerpos impuros.Diluye la muestra. No paraIgG.Caro.Caro. Muchos pasos.Antígenos puros.Inactivación de anticuerpos.Caro. Rendimiento bajo amoderado. Muchos pasos.2- Fraccionamiento de anticuerposEl uso de un anticuerpo intacto en algunas técnicas inmunoquímicas introduce ciertosproblemas. Por ejemplo, muchas células tienen receptores para el fragmento Fc de losanticuerpos y al interaccionar con ellos puede ocurrir activación celular, lisis, etc. Estosproblemas se pueden resolver si se utilizan fragmentos de anticuerpos.Como método de estudio de la estructura de las inmunoglobulinas, se han empleadoenzimas proteolíticas que clivan a los anticuerpos en diferentes fragmentos. <strong>La</strong>s enzimas quemás se utilizan son la papaína, la tripsina y la pepsina. En la figura 2 se muestran losresultados esperados de la digestión de los anticuerpos con las diferentes enzimas. <strong>La</strong> papaína cliva la molécula de IgG en tres fragmentos de semejante peso molecular (45 a50kDa). Dos de estos fragmentos, idénticos entre sí, son denominados Fab (fragmento deunión al Ag). En ellos reside la capacidad de reconocimiento antigénico, expresando una únicavalencia. El tercer fragmento, denominado Fc (fragmento cristalizable) no participa en elreconocimiento antigénico. <strong>La</strong> tripsina actúa de manera similar a la papaína y permite obtener los mismos fragmentos. <strong>La</strong> pepsina, por su parte, cliva el fragmento Fc en piezas pequeñas y deja el resto de lamolécula intacta. Esta porción intacta, denominada (Fab’) 2 , se halla constituida por dosfragmentos Fab unidos a través de los puentes disulfuro intercatenarios. Presenta, por lo tanto,dos sitios de reconocimiento antigénico por lo que su valencia es dos.34