Ouvrir le document PDF (5 mb) - VSAO Journal
Ouvrir le document PDF (5 mb) - VSAO Journal
Ouvrir le document PDF (5 mb) - VSAO Journal
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
PERSPECTIVES<br />
en cellu<strong>le</strong>s qui resse<strong>mb</strong><strong>le</strong>nt <strong>le</strong> plus à l’endoderme,<br />
donc à la structure à partir de<br />
laquel<strong>le</strong> se différencie ensuite <strong>le</strong> pancréas.<br />
Par <strong>le</strong> biais de plusieurs étapes supplémentaires,<br />
on est ensuite parvenu à obtenir<br />
des cellu<strong>le</strong>s productrices d’insuline.<br />
Ce n’est que cette année qu’a été publiée<br />
une version améliorée de ce protoco<strong>le</strong>,<br />
avec <strong>le</strong>quel on est parvenu à produire, à<br />
partir de cellu<strong>le</strong>s souches e<strong>mb</strong>ryonnaires<br />
humaines, des cellu<strong>le</strong>s productrices d’insuline<br />
sécrétant correctement de l’insuline<br />
lors d’une augmentation du glucose<br />
et permettant, après transplantation dans<br />
une souris diabétique, de corriger l’hyperglycémie<br />
[5].<br />
Parmi ces cellu<strong>le</strong>s productrices d’insuline<br />
se trouvaient éga<strong>le</strong>ment d’autres cellu<strong>le</strong>s<br />
pancréatiques et mésenchyma<strong>le</strong>s. Il a<br />
éga<strong>le</strong>ment été observé l’apparition d’un<br />
tératome. Celui-ci montre d’une part<br />
l’énorme potentiel de prolifération des<br />
cellu<strong>le</strong>s souches e<strong>mb</strong>ryonnaires et d’autre<br />
part la difficulté de bien contrô<strong>le</strong>r ce potentiel<br />
de croissance. Ces éléments constituent,<br />
en plus des réserves d’ordre éthique,<br />
<strong>le</strong> principal obstac<strong>le</strong> à l’utilisation de<br />
cellu<strong>le</strong>s souches e<strong>mb</strong>ryonnaires pour <strong>le</strong><br />
traitement du diabète sucré de type 1.<br />
Cellu<strong>le</strong>s souches<br />
dans <strong>le</strong> pancréas<br />
Les cellu<strong>le</strong>s souches ou cellu<strong>le</strong>s précurseur,<br />
qui ont <strong>le</strong> potentiel de se différencier<br />
en cellu<strong>le</strong>s productrices d’insuline, ont été<br />
décrites dans <strong>le</strong>s îlots pancréatiques, dans<br />
<strong>le</strong>s voies pancréatiques et éga<strong>le</strong>ment dans<br />
la partie exocrine du pancréas, dans <strong>le</strong>s<br />
cellu<strong>le</strong>s acineuses. Un problème important<br />
de la recherche sur <strong>le</strong>s cellu<strong>le</strong>s souches<br />
dans <strong>le</strong> pancréas est posé par l’absence<br />
d’un marqueur de cellu<strong>le</strong> souche<br />
qui permettrait d’identifier <strong>le</strong>s cellu<strong>le</strong>s<br />
adéquates. Le marqueur de cellu<strong>le</strong> souche<br />
Nestin [6] qui a été pour la première fois<br />
décrit en 2001 dans <strong>le</strong> pancréas de la souris,<br />
du rat et de l’homme se trouve certes<br />
dans beaucoup de cellu<strong>le</strong>s pouvant potentiel<strong>le</strong>ment<br />
faire office de cellu<strong>le</strong> souche et<br />
constitue déjà un marqueur de cellu<strong>le</strong><br />
souche reconnu dans <strong>le</strong> système nerveux<br />
central, mais ce marqueur n’est pas suffisamment<br />
spécifique pour identifier de<br />
manière univoque des cellu<strong>le</strong>s présentant<br />
<strong>le</strong> potentiel requis (capacité de se développer<br />
en cellu<strong>le</strong>s bêta). Cette première<br />
description de cet éventuel marqueur de<br />
cellu<strong>le</strong> souche dans <strong>le</strong> pancréas a malgré<br />
26 <strong>VSAO</strong> JOURNAL ASMAC<br />
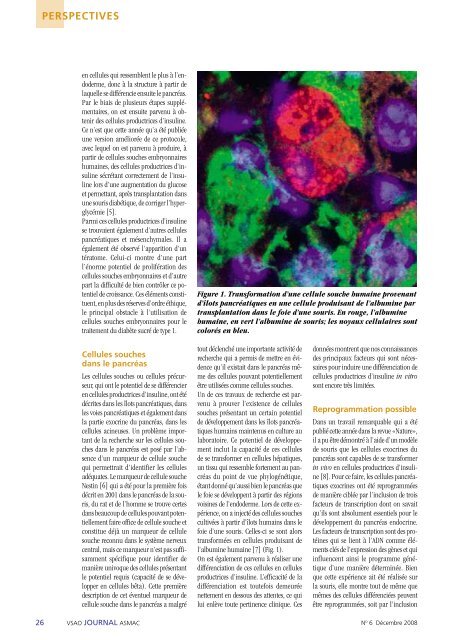
Figure 1. Transformation d’une cellu<strong>le</strong> souche humaine provenant<br />
d’îlots pancréatiques en une cellu<strong>le</strong> produisant de l’albumine par<br />
transplantation dans <strong>le</strong> foie d’une souris. En rouge, l’albumine<br />
humaine, en vert l’albumine de souris; <strong>le</strong>s noyaux cellulaires sont<br />
colorés en b<strong>le</strong>u.<br />
tout déc<strong>le</strong>nché une importante activité de<br />
recherche qui a permis de mettre en évidence<br />
qu’il existait dans <strong>le</strong> pancréas même<br />
des cellu<strong>le</strong>s pouvant potentiel<strong>le</strong>ment<br />
être utilisées comme cellu<strong>le</strong>s souches.<br />
Un de ces travaux de recherche est parvenu<br />
à prouver l’existence de cellu<strong>le</strong>s<br />
souches présentant un certain potentiel<br />
de développement dans <strong>le</strong>s îlots pancréatiques<br />
humains maintenus en culture au<br />
laboratoire. Ce potentiel de développement<br />
inclut la capacité de ces cellu<strong>le</strong>s<br />
de se transformer en cellu<strong>le</strong>s hépatiques,<br />
un tissu qui resse<strong>mb</strong><strong>le</strong> fortement au pancréas<br />
du point de vue phylogénétique,<br />
étant donné qu’aussi bien <strong>le</strong> pancréas que<br />
<strong>le</strong> foie se développent à partir des régions<br />
voisines de l’endoderme. Lors de cette expérience,<br />
on a injecté des cellu<strong>le</strong>s souches<br />
cultivées à partir d’îlots humains dans <strong>le</strong><br />
foie d’une souris. Cel<strong>le</strong>s-ci se sont alors<br />
transformées en cellu<strong>le</strong>s produisant de<br />
l’albumine humaine [7] (Fig. 1).<br />
On est éga<strong>le</strong>ment parvenu à réaliser une<br />
différenciation de ces cellu<strong>le</strong>s en cellu<strong>le</strong>s<br />
productrices d’insuline. L’efficacité de la<br />
différenciation est toutefois demeurée<br />
nettement en dessous des attentes, ce qui<br />
lui enlève toute pertinence clinique. Ces<br />
données montrent que nos connaissances<br />
des principaux facteurs qui sont nécessaires<br />
pour induire une différenciation de<br />
cellu<strong>le</strong>s productrices d’insuline in vitro<br />
sont encore très limitées.<br />
Reprogrammation possib<strong>le</strong><br />
Dans un travail remarquab<strong>le</strong> qui a été<br />
publié cette année dans la revue «Nature»,<br />
il a pu être démontré à l’aide d’un modè<strong>le</strong><br />
de souris que <strong>le</strong>s cellu<strong>le</strong>s exocrines du<br />
pancréas sont capab<strong>le</strong>s de se transformer<br />
in vivo en cellu<strong>le</strong>s productrices d’insuline<br />
[8]. Pour ce faire, <strong>le</strong>s cellu<strong>le</strong>s pancréatiques<br />
exocrines ont été reprogrammées<br />
de manière ciblée par l’inclusion de trois<br />
facteurs de transcription dont on savait<br />
qu’ils sont absolument essentiels pour <strong>le</strong><br />
développement du pancréas endocrine.<br />
Les facteurs de transcription sont des protéines<br />
qui se lient à l’ADN comme éléments<br />
clés de l’expression des gènes et qui<br />
influencent ainsi <strong>le</strong> programme génétique<br />
d’une manière déterminée. Bien<br />
que cette expérience ait été réalisée sur<br />
la souris, el<strong>le</strong> montre tout de même que<br />
mêmes des cellu<strong>le</strong>s différenciées peuvent<br />
être reprogrammées, soit par l’inclusion<br />
N o 6 Déce<strong>mb</strong>re 2008