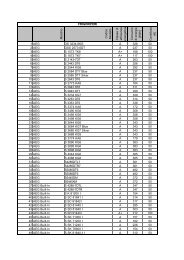
informatoregennaio2010 - Unione del Commercio di Milano
informatoregennaio2010 - Unione del Commercio di Milano
informatoregennaio2010 - Unione del Commercio di Milano
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Legale<br />
gennaio 2010<br />
Varie<br />
riduzione dei rischi <strong>del</strong>le malattie dei bambini.<br />
Tutte le in<strong>di</strong>cazioni sulla salute incluse negli elenchi <strong>di</strong> cui agli<br />
articoli 13 e 14 possono venire utilizzate da qualsiasi operatore<br />
nel rispetto <strong>del</strong>le con<strong>di</strong>zioni stabilite, se il loro uso non è<br />
limitato ex art. 21.<br />
L’articolo 15 illustra invece la procedura per l’autorizzazione<br />
sulla riduzione <strong>del</strong> rischio <strong>del</strong>la malattia e <strong>di</strong> quelle relative<br />
allo sviluppo e salute dei bambini.<br />
L’articolo 18 descrive la procedura per richiedere l’inclusione<br />
<strong>di</strong> in<strong>di</strong>cazioni sulla salute non comprese nell’elenco comunitario<br />
previsto dall’art. 13 <strong>del</strong> regolamento, mentre l’articolo 19<br />
illustra le attività per mo<strong>di</strong>ficare sospendere o revocare un’<br />
in<strong>di</strong>cazione sulla salute già inserita negli elenchi <strong>di</strong> cui agli<br />
articoli 13 e14.<br />
Le in<strong>di</strong>cazioni comparative<br />
Fatta salva la <strong>di</strong>rettiva 84/450/Cee (pubblicità ingannevole e<br />
comparativa), il confronto può essere fatto soltanto tra alimenti<br />
<strong>del</strong>la stessa categoria prendendo in considerazione una<br />
gamma <strong>di</strong> alimenti <strong>di</strong> tale categoria: la <strong>di</strong>fferenza nella quantità<br />
<strong>di</strong> una sostanza nutritiva e/o nel valore energetico è specificata<br />
e il confronto è riferito alla stessa quantità <strong>di</strong> prodotto.”<br />
(art. 9.1).<br />
Per stessa categoria <strong>di</strong> prodotto si intende quella caratterizzata<br />
da omogeneità <strong>di</strong> materie prime e <strong>di</strong> modalità <strong>di</strong> consumo.<br />
Si ritengono in ogni caso ammissibili le comparazioni tra l’alimento<br />
naturale e il suo <strong>di</strong>retto derivato.<br />
A tal proposito si ritiene opportuno richiamare la normativa in<br />
tema <strong>di</strong> pubblicità ingannevole e comparativa per ricordare la<br />
necessità <strong>di</strong> <strong>di</strong>sporre <strong>di</strong> un idoneo materiale comprovante l’omogeneità<br />
dei prodotti messi a confronto.<br />
Modalità operative<br />
Tutte le in<strong>di</strong>cazioni - nutrizionali e sulla salute - possono essere<br />
ammesse solo a seguito <strong>di</strong> un esito favorevole <strong>del</strong>la procedura<br />
comunitaria <strong>di</strong> autorizzazione, la quale vede coinvolti l’impren<strong>di</strong>tore,<br />
l’autorità nazionale, l’Efsa (autorità europea per la<br />
sicurezza alimentare, vedasi la scheda per approfon<strong>di</strong>re il<br />
ruolo <strong>del</strong>l’Efsa nella procedura) e la Commissione europea.<br />
Tale procedura si articola come segue:<br />
* l’operatore presenta la domanda <strong>di</strong> autorizzazione all’uso<br />
<strong>del</strong>l’in<strong>di</strong>cazione all’autorità nazionale competente;<br />
* l’autorità nazionale informa l’Efsa;<br />
* L’Efsa, informata la Commissione europea e gli altri Stati<br />
membri, rende pubblica la sintesi <strong>del</strong>la domanda;<br />
* entro 5 mesi dal ricevimento <strong>del</strong>la domanda l’Efsa pubblica<br />
il proprio parere e lo trasmette alla Commissione europea;<br />
* entro il 30 gg chiunque può rivolgere osservazioni alla<br />
Commissione;<br />
* entro 2 mesi dal ricevimento <strong>del</strong> parere <strong>del</strong>l’autorità, la<br />
Commissione presenta al comitato <strong>del</strong>la filiera alimentare ed il<br />
benessere animale un progetto <strong>di</strong> decisione;<br />
* la decisione definitiva <strong>del</strong> Comitato sulla domanda adottata<br />
è comunicata dalla Commissione all’impresa richiedente e<br />
pubblicata nella Gazzetta ufficiale.<br />
La Commissione europea dovrà quin<strong>di</strong> istituire e tenere<br />
aggiornato un registro comunitario <strong>del</strong>le in<strong>di</strong>cazioni nutrizionali<br />
e sulla salute approvate secondo la procedura appena<br />
descritta. Il registro presenterà anche un elenco <strong>del</strong>le in<strong>di</strong>cazioni<br />
sulla salute respinte ed il motivo <strong>del</strong> rigetto.<br />
Il registro comunitario è uno strumento accessibile al pubblico<br />
e gli stati membri non potranno limitare o proibire il commercio<br />
o la pubblicità <strong>di</strong> prodotti alimentari conformi alle <strong>di</strong>sposizioni<br />
regolamentari.<br />
Le in<strong>di</strong>cazioni devono essere comprese dal consumatore<br />
me<strong>di</strong>o, normalmente informato e ragionevolmente attento ed<br />
avveduto: nella valutazione <strong>del</strong>le capacità <strong>del</strong> consumatore si<br />
devono tenere in considerazione gli eventuali fattori sociali,<br />
culturali e linguistici, Il consumatore deve essere in grado <strong>di</strong><br />
valutare la qualità nutrizionale complessiva.<br />
La fondatezza scientifica deve essere l’aspetto principale nell’utilizzo<br />
<strong>del</strong>le in<strong>di</strong>cazioni nutrizionali e salutistiche, che devono<br />
essere corroborate da dati scientifici e da vali<strong>di</strong> elementi <strong>di</strong><br />
prova.<br />
È inoltre previsto che uno Stato che ritiene un’in<strong>di</strong>cazione non<br />
conforme al regolamento possa, per gravi motivi, sospendere<br />
temporaneamente l’impiego <strong>del</strong> relativo prodotto sul proprio<br />
territorio: in questo caso deve essere attivata la procedura <strong>di</strong><br />
informazione rivolta alla Commissione.<br />
Ulteriori approfon<strong>di</strong>menti<br />
Il testo consolidato <strong>del</strong> Regolamento n. 1924/2006 si trova su<br />
http://eur-lex.europa.eu: esso ha infatti subito alcune mo<strong>di</strong>fiche<br />
ad opera dei regolamenti (Ce) 107 e 109 <strong>del</strong> 2008,<br />
entrambi pubblicati nella Guce L 39 <strong>del</strong> 13 febbraio 2008.<br />
Gli “ atti collegati” al regolamento sono:<br />
* il regolamento (Ce) n. 353/2008 <strong>del</strong>la Commissione <strong>del</strong> 18<br />
aprile 2008 che fissa le norme d’attuazione per le domande<br />
che autorizzano le in<strong>di</strong>cazioni sulla salute previste dall’articolo<br />
15 <strong>del</strong> regolamento (Ce) n. 1924/2006 <strong>del</strong> Parlamento<br />
europeo e <strong>del</strong> Consiglio [Gazzetta ufficiale L 109 <strong>del</strong><br />
19.4.2008].<br />
* Il regolamento riguarda le norme da rispettare per la presentazione<br />
<strong>di</strong> una domanda <strong>di</strong> autorizzazione <strong>del</strong>le in<strong>di</strong>cazioni<br />
sulla salute. Ogni domanda <strong>di</strong> autorizzazione verterà<br />
esclusivamente su una in<strong>di</strong>cazione sulla salute e comprenderà<br />
una descrizione <strong>del</strong> tipo <strong>di</strong> in<strong>di</strong>cazione sulla salute, una proposta<br />
<strong>di</strong> formulazione, le con<strong>di</strong>zioni specifiche per l’uso e i<br />
dati scientifici che giustificano l’in<strong>di</strong>cazione sulla salute.<br />
* il regolamento (Ce) n. 1925/2006 <strong>del</strong> Parlamento europeo<br />
e <strong>del</strong> Consiglio, <strong>del</strong> 20 <strong>di</strong>cembre 2006, riguardante l’aggiunta<br />
<strong>di</strong> vitamine, <strong>di</strong> minerali e <strong>di</strong> alcune altre sostanze ai prodotti<br />
alimentari [Gazzetta ufficiale L 404 <strong>del</strong> 30.12.2006].<br />
* Questo regolamento vieta l’aggiunta <strong>di</strong> vitamine e <strong>di</strong> sostanze<br />
minerali agli alimenti freschi e alle bevande contenenti un volume<br />
<strong>di</strong> alcol superiore all’1,2%. Alcune bevande alcoliche tra<strong>di</strong>zionali<br />
che contengono tali sostanze sono peraltro autorizzate,<br />
tuttavia non possono presentare in<strong>di</strong>cazioni nutrizionali.<br />
Entrata in vigore<br />
La pubblicazione <strong>del</strong>la lista dei claims ammessi e, quin<strong>di</strong>, il<br />
loro inserimento nel registro comunitario è prevista per il 31<br />
gennaio 2010 (ve<strong>di</strong> art. 13 - comma 3).<br />
Si stima opportuno sottolineare che la lista trasmessa dal ministero<br />
<strong>del</strong>la Salute alla Commissione europea in data 31 gennaio<br />
2008 ha il significato <strong>di</strong> una raccolta <strong>di</strong> in<strong>di</strong>cazioni da<br />
sottoporre ad una valutazione scientifica al più alto livello e<br />
non <strong>di</strong> in<strong>di</strong>cazioni già autorizzate.<br />
LEGALE<br />
81