Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Jefe <strong>de</strong> Línea /<br />
Group Lea<strong>de</strong>r:<br />
María Luisa Toribio García<br />
Desarrollo <strong>de</strong>l sistema<br />
linfohematopoyético humano<br />
Development of the human<br />
lymphohematopoietic system<br />
C15<br />
Publicaciones<br />
Publications<br />
Resumen <strong>de</strong> investigación<br />
Research summary<br />
Soulier, J., Clappier, E., Cayuela, J.M., Regnault, A., Garcia-Peydro,<br />
M., Dombret, H., Baruchel, A., Toribio, M.L. and Sigaux, F. (2005).<br />
HOXA genes are inclu<strong>de</strong>d in genetic and biologic networks <strong>de</strong>fining<br />
human acute T-cell leukemia (T-ALL). Blood. 106, 274-286.<br />
Personal Científico /<br />
Scientific Staff:<br />
Virginia García <strong>de</strong> Yébenes<br />
Marina García Peydró<br />
Patricia Fuentes Villarejo<br />
Sara Pérez Luz<br />
Becarios Predoctorales /<br />
Predoctoral Fellows:<br />
María <strong>de</strong> las Nieves Navarro Lobato<br />
Enrique Martín Gayo<br />
Sara González García<br />
Técnicos <strong>de</strong> Investigación /<br />
Technical Assistance:<br />
Juan Alcain Sánchez<br />
Inmunología y Virología Immunology and Virology<br />
El interés general <strong>de</strong> nuestro grupo es el entendimiento <strong>de</strong> las<br />
bases moleculares y celulares que <strong>de</strong>terminan la generación<br />
<strong>de</strong>l sistema hematolinfoi<strong>de</strong> a partir <strong>de</strong> progenitores<br />
multipotenciales hematopoyéticos (HSC). Las HSCs son<br />
células troncales con capacidad <strong>de</strong> auto-renovarse y <strong>de</strong><br />
generar los diferentes tipos celulares <strong>de</strong>l sistema sanguíneo.<br />
Durante los dos últimos años, nuestro estudio se ha centrado<br />
en la contribución <strong>de</strong> la vía <strong>de</strong> señalización <strong>de</strong> Notch1 a<br />
ambos procesos. Utilizando mo<strong>de</strong>los in vitro <strong>de</strong> activación<br />
constitutiva o inducida por ligando, hemos <strong>de</strong>mostrado que<br />
Notch1 ejerce una función esencial inhibiendo la<br />
diferenciación <strong>de</strong> los progenitores multipotenciales presentes<br />
en el timo humano en distintos linajes celulares (macrófagos,<br />
células <strong>de</strong>ndríticas y células NK), y permitiendo,<br />
simultáneamente, su mantenimiento y auto-renovación en<br />
respuesta a señales locales (interleuquina 7, IL7). Por tanto,<br />
las vías <strong>de</strong> Notch y <strong>de</strong> IL-7 cooperan para amplificar la<br />
población <strong>de</strong> progenitores con potencial linfoi<strong>de</strong> T presente<br />
en el timo. La <strong>de</strong>mostración <strong>de</strong> que la señalización por<br />
Notch1 es esencial para el control <strong>de</strong>l balance entre autorenovación<br />
y diferenciación <strong>de</strong> los progenitores<br />
hematopoyéticos proporciona una información relevante para<br />
la optimización <strong>de</strong> protocolos <strong>de</strong> expansión ex vivo <strong>de</strong> HSCs<br />
humanas <strong>de</strong> aplicación en terapias regenerativas.<br />
La capacidad <strong>de</strong> auto-renovación es también una<br />
característica <strong>de</strong> las células tumorales. A<strong>de</strong>más, la<br />
señalización por Notch se ha implicado en la generación <strong>de</strong><br />
leucemias, en concreto <strong>de</strong> leucemias linfoblásticas agudas<br />
T (T-ALL), lo que sugiere que las células tumorales y las<br />
células troncales comparten mecanismos moleculares <strong>de</strong><br />
auto-renovación. Mediante estudios <strong>de</strong> expresión genética<br />
se han caracterizado distintos subtipos <strong>de</strong> T-ALL que<br />
recapitulan los patrones genéticos <strong>de</strong> sucesivos estadios<br />
madurativos intratímicos. Ello ha permitido i<strong>de</strong>ntificar un<br />
grupo <strong>de</strong> genes cuya <strong>de</strong>sregulación durante el <strong>de</strong>sarrollo<br />
intratímico es un evento critico en la oncogénesis <strong>de</strong> la T-<br />
ALL. Nuestros estudios actuales están dirigidos a enten<strong>de</strong>r<br />
los mecanismos diferenciales que <strong>de</strong>terminan la autorenovación<br />
<strong>de</strong> las células tronco hematopoyéticas y <strong>de</strong> las<br />
células leucémicas.<br />
Our main interest is the study of the cellular and molecular<br />
bases that control the generation of the hematolymphoid<br />
system from multipotent hematopoietic progenitors (HSC).<br />
HSCs have the potential to self-renew and to generate all<br />
blood cell types. During the last two years, our research has<br />
focused on the un<strong>de</strong>rstanding of the role that the Notch<br />
signaling pathway plays in both processes. By using in vitro<br />
differentiation assays and both constitutive and ligand<strong>de</strong>pen<strong>de</strong>nt<br />
Notch1 activation, we showed that Notch1<br />
signaling plays a prominent role in inhibiting non-T cell<br />
differentiation (macrophages, <strong>de</strong>ndritic cells, NK cells) of<br />
human primitive intrathymic progenitors, while sustaining<br />
their expansion in response to unique interleukin 7 (IL-7)<br />
<strong>de</strong>rived signals. Therefore, Notch1 and IL-7 pathways<br />
cooperate to amplify the pool of early T-cell progenitors<br />
present in the human thymus. The finding that Notch1<br />
signaling is essential to control the balance between selfrenewal<br />
and differentiation of hematopoietic precursors is<br />
relevant for the optimization of protocols of ex vivo<br />
expansion of human HSCs used in regenerative medicine.<br />
Self-renewal is also a characteristic of tumor cells. In<br />
addition, Notch1 signaling is involved in the generation of<br />
leukemia, particularly T cell acute lymphoblastic leukemia<br />
(T-ALL), suggesting that tumor cells and stem cells share<br />
common mechanisms of self-renewal. Based on gene<br />
expression analyses, we have characterized different T-ALL<br />
subtypes that recapitulate the sequential steps of<br />
intrathymic <strong>de</strong>velopment. This has allowed the i<strong>de</strong>ntification<br />
of a set of <strong>de</strong>velopmental genes whose abnormal<br />
expression during <strong>de</strong>velopment is critical in T-ALL<br />
oncogenesis. Current studies focus on the un<strong>de</strong>rstanding of<br />
the differential mechanisms that control self-renewal of stem<br />
cells and leukemic cells.<br />
Garcia-Peydro, M., <strong>de</strong> Yebenes, V.G. and Toribio, M.L. (2006). Notch1<br />
and IL-7 receptor interplay maintains proliferation of human thymic<br />
progenitors while suppressing non-T cell fates.<br />
J. Immunol. 177, 3711-3720.<br />
Tesis doctorales<br />
Doctoral Theses<br />
María <strong>de</strong> las Nieves Navarro Lobato. (2006). Función <strong>de</strong> la ca<strong>de</strong>na<br />
pTα en la regulación <strong>de</strong> la expresión en membrana y señalización<br />
<strong>de</strong>l complejo pre-TCR humano. Sobresaliente cum lau<strong>de</strong>.<br />
CBM 2005/2006<br />
84<br />
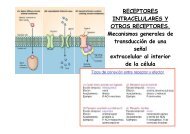
Figura 1. Notch1 inhibe la diferenciación <strong>de</strong> los progenitores linfomieloi<strong>de</strong>s<br />
intratímicos humanos en células no-T.<br />
Figure 1. Notch1 signaling inhibits non-T cell differentiation of human lymphomyeloid<br />
intrathymic precursors.<br />
85