Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
Drosophila - Severo Ochoa - Universidad Autónoma de Madrid
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Jefe <strong>de</strong> Línea /<br />
Group Lea<strong>de</strong>r:<br />
Fe<strong>de</strong>rico Mayor<br />
Mecanismos <strong>de</strong> señalización y<br />
regulación <strong>de</strong> receptores acoplados<br />
a proteínas G<br />
G protein-coupled receptors<br />
signaling and regulatory mechanisms<br />
D8<br />
Personal Científico /<br />
Scientific Staff:<br />
Ana Ruíz-Gómez<br />
Cristina Murga<br />
Catalina Ribas<br />
Petronila Penela<br />
Postdoctorales /<br />
Postdoctoral:<br />
Ivette Aymerich<br />
Pieter Cobelens<br />
Becarios Predoctorales /<br />
Predoctoral Fellows:<br />
Alicia Salcedo<br />
Carlota García-Hoz<br />
Helena Holguín<br />
María Jurado<br />
Pedro Campos<br />
Raúl Alvarado<br />
Vinatha Sreeramkumar<br />
Técnicos <strong>de</strong> Investigación /<br />
Technical Assistance:<br />
Susana Rojo<br />
Verónica Rivas<br />
Científicos Visitantes /<br />
Visiting Scientists:<br />
Dr. Ricardo Caballero<br />
Neurobiología Neurobiology<br />
Resumen <strong>de</strong> investigación<br />
Las quinasas <strong>de</strong> receptores acoplados a proteínas G<br />
(GRKs) participan junto con las arrestinas, en los procesos<br />
<strong>de</strong> regulación <strong>de</strong> múltiples receptores acoplados a<br />
proteínas G (GPCR) <strong>de</strong> gran relevancia fisiológica y<br />
farmacológica. Datos recientes indican que, a<strong>de</strong>más, tanto<br />
arrestinas como GRKs participan en la propagación <strong>de</strong> la<br />
señal, mediante el reclutamiento a localizaciones<br />
específicas <strong>de</strong> diversos componentes <strong>de</strong> vías <strong>de</strong><br />
transducción, tanto <strong>de</strong> GPCR como <strong>de</strong> otros tipos <strong>de</strong><br />
receptores <strong>de</strong> membrana. Se están caracterizando<br />
complejos mecanismos <strong>de</strong> regulación <strong>de</strong> la expresión,<br />
<strong>de</strong>gradación y función <strong>de</strong> las GRKs, y se ha <strong>de</strong>scrito que los<br />
niveles <strong>de</strong> algunas <strong>de</strong> estas quinasas se encuentran<br />
alterados en varias situaciones patológicas, como el fallo<br />
cardiaco, hipertensión, inflamación, o ciertos tumores, lo<br />
que sugiere que las GRKs pue<strong>de</strong>n contribuir al <strong>de</strong>sarrollo<br />
<strong>de</strong> esas importantes enfermeda<strong>de</strong>s.<br />
Por otra parte, con la activa participación <strong>de</strong> nuestro grupo,<br />
datos recientes están <strong>de</strong>svelando nuevas interacciones<br />
funcionales <strong>de</strong> las GRKs (en particular <strong>de</strong> la isoforma<br />
GRK2) con vías <strong>de</strong> señalización importantes en la función<br />
<strong>de</strong>l sistema cardiovascular e inmune (MAPK, PI3K, p38<br />
MAPK, Gαq, Src), diversas proteínas relacionadas con el<br />
control <strong>de</strong> la proliferación y la supervivencia celular (Mdm2)<br />
o migración celular y procesos <strong>de</strong> metástasis (GIT, PI3K,<br />
receptores <strong>de</strong> quimioquinas).<br />
En ese contexto, el objetivo general <strong>de</strong> nuestro laboratorio<br />
es profundizar en el conocimiento integrado <strong>de</strong> las<br />
interacciones <strong>de</strong> las GRKs con distintas proteínas celulares,<br />
con el fin <strong>de</strong> compren<strong>de</strong>r mejor su contribución al control <strong>de</strong><br />
procesos celulares básicos (ciclo celular, proliferación,<br />
migración, vías <strong>de</strong> señalización), enten<strong>de</strong>r cómo pue<strong>de</strong><br />
alterase su expresión y/o funcionalidad en distintas<br />
situaciones patológicas, y ayudar a esclarecer cómo esas<br />
alteraciones participan en el <strong>de</strong>senca<strong>de</strong>namiento o en la<br />
progresión <strong>de</strong> diversas enfermeda<strong>de</strong>s cardiovasculares,<br />
neoplásicas o inflamatorias, para contribuir al diseño <strong>de</strong><br />
nuevas estrategias diagnósticas y terapéuticas.<br />
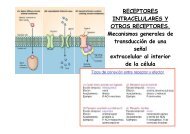
Figura1. Mo<strong>de</strong>lo propuesto para la modulación <strong>de</strong> las interacciones funcionales<br />
entre GRK2 y Mdm2 por diferentes estímulos.<br />
Figura1.Proposed mo<strong>de</strong>l for the modulation of Mdm2/GRK2 functional interactions<br />
by different stimuli.<br />
Research summary<br />
The G protein -coupled receptor kinases (GRKs) participate<br />
together with arrestins in the regulation of multiple G proteincoupled<br />
receptors (GPCR) of key physiological and<br />
pharmacological relevance. Recent data indicate that, on<br />
top of that, both arrestins and GRKs participate in the signal<br />
propagation by means of the recruitment to specific cellular<br />
locations of different components of transduction pathways.<br />
The complex mechanisms un<strong>de</strong>rlying regulation of GRK<br />
expression, <strong>de</strong>gradation and function are being unveiled<br />
and the levels of these kinases have been <strong>de</strong>scribed to be<br />
altered in several pathological situations such as cardiac<br />
failure, hypertension, inflammation or certain types of<br />
tumors, what suggests that GRKs may contribute to the<br />
<strong>de</strong>velopment of those important pathologies.<br />
On the other hand, with an active participation by our group,<br />
recent data have unveiled new functional interactions of<br />
GRKs (in particular of the GRK2 isoform) with signaling<br />
pathways important in the cardiovascular and immune<br />
systems (MAPK, PI3K, p38MAPK, Gαq, Src), diverse<br />
proteins implicated in the control of cell proliferation and<br />
survival (Mdm2) or in cell migration and metastatic<br />
processes (GIT, PI3K, chemokine receptors).<br />
In this context, the overall goal of our laboratory is to <strong>de</strong>epen<br />
the knowledge of GRK interactions with different cellular<br />
proteins, with the aim to better un<strong>de</strong>rstand its contribution to<br />
basic cellular processes (cell cycle, proliferation, migration,<br />
signaling pathways), to search for novel cell targets and<br />
physiological functions for GRKs, to un<strong>de</strong>rstand how its<br />
expression and/or functionality is altered in different<br />
pathological conditions, and to help clarify how these<br />
alterations participate in the progression or triggering of<br />
several cardiovascular, neoplasic or inflammatory diseases,<br />
thus contributing to the <strong>de</strong>sign of novel therapeutic and<br />
diagnostic strategies.<br />
Publicaciones<br />
Publications<br />
Mayor, F. (2005). Mecanismos <strong>de</strong> señalización celular: implicaciones fisiopatológicas. En “Mecanismos<br />
moleculares y neuroendocrinos <strong>de</strong>l balance energético: Patologías”. Instituto <strong>de</strong> España. Real Aca<strong>de</strong>mia<br />
Nacional <strong>de</strong> Farmacia. Editora Ana María Pascual-Leone Pascual, pags. 95-124.<br />
Jiménez-Sainz, M.C., Murga, C., Kavelaars, A., Jurado-Pueyo, M., Kraastak, B.F., Heijnen, C., Mayor F Jr,<br />
Aragay, A. (2006). G protein-coupled receptor kinase 2 negatively regulates chemokine signaling at a<br />
level downstream of G protein subunits. Mol. Biol. Cell., 17, 25-31.<br />
Penela, P., Murga, C., Ribas, C. Tutor, A.S., Peregrín, S., Mayor F Jr, (2006) Mechanisms of regulation of G-<br />
protein-coupled receptor kinases (GRKs) and cardiovascular disease. Cardiovasc. Res., 69, 465-56.<br />
Mariggio, S, García-Hoz, C., Sarnago, S., De Blasi, A., Mayor F Jr, Ribas, C. (2006). Tyrosine<br />
phosphorylation of G-protein-coupled-receptor kinase 2 (GRK2) by c-Src modulates its interaction with<br />
Galphaq. Cellullar Signaling, 18, 2004-12.<br />
P. (2006). Association of 14-3-3 Proteins to {beta}1-Adrenergic<br />
Receptors Modulates Kv11.1 K+ Channel Activity in Recombinant<br />
Systems. Mol. Biol. Cell. 17, 4666-74.<br />
Peregrin, S., Jurado, M., Campos, P, Sanz-Moreno, V., Ruiz-Gómez, A.,<br />
Crespo, P., Mayor F Jr, Murga C. (2006). Phosphorylation by GRK2 at<br />
the docking groove unveils a novel mechanism for inactivating<br />
p38MAPK. Current Biology 16, 2042-7.<br />
Ribas, C., Penela, P., Murga, C., Salcedo, A.,García-Hoz, C., Jurado-<br />
Pueyo, M., Aymerich, I., Mayor F Jr, (2006). The G protein-coupled<br />
receptor kinase (GRK) interactome in GPCR regulation and signaling.<br />
BBA Biomembranes.<br />
Ruiz-Gómez, A., Molnar, C., Holguín, H., Mayor F Jr., <strong>de</strong> Celis, J.F.<br />
(2006). The cell biology of Smo signalling and its relationships with<br />
GPCRs. BBA Biomembranes.<br />
Tesis doctorales<br />
Doctoral Theses<br />
Antonio Sobrado <strong>de</strong> Vicente-Tutor. (2005). Nuevas vías <strong>de</strong><br />
señalización mediadas por receptores β1-adrenérgicos.<br />
Sandra Peregrín Pedrique. (2005). Papel <strong>de</strong> las proteínas reguladoras<br />
<strong>de</strong> receptores acoplados a proteínas G en la función y disfunción <strong>de</strong>l<br />
sistema cardiovascular: interacciones funcionales entre GRKs y vías<br />
<strong>de</strong> señalización MAPK.<br />
Patentes<br />
Patents<br />
F. Mayor, C. Murga, S. Peregrín .M. Jurado, P. Campos. New<br />
phosphorylation site of mitogen-activated protein kinases, modified<br />
proteins and applications (PCT/EP2006/005542).<br />
Otras activida<strong>de</strong>s<br />
Other Activities<br />
Member of the Advisory Board of the Spanish Minister of Health /<br />
Miembro <strong>de</strong>l Consejo Asesor <strong>de</strong> la Ministra <strong>de</strong> Sanidad.<br />
Member of the Scientific Committee of the Lilly Foundation / Miembro<br />
<strong>de</strong>l Consejo Científico <strong>de</strong> la Fundación Lilly.<br />
Member of the Executive Board of the Spanish Foundation for Science<br />
and Technology (FECYT) (2001-2005) / Miembro <strong>de</strong>l Consejo<br />
Científico y Tecnológico <strong>de</strong> la Fundación Española <strong>de</strong> la Ciencia<br />
y la Tecnología (FECYT).<br />
Director. Department of Molecular Biology. <strong>Universidad</strong> Autónoma <strong>de</strong><br />
<strong>Madrid</strong> / Director, Departamento <strong>de</strong> Biología Molecular. <strong>Universidad</strong><br />
Autónoma <strong>de</strong> <strong>Madrid</strong>.<br />
Member of the Scientific Advisory Board of different institutions, as<br />
Institut Pi i Sunyer <strong>de</strong> Investigaciones Biomédicas (IDIBAPS) and<br />
Centro Superior en Alta Tecnología Científica para la Investigación<br />
en Biomedicina y Trasplantes <strong>de</strong> Tejidos y Organos <strong>de</strong> la Comunidad<br />
Valenciana (CSAT) / Miembro <strong>de</strong>l Consejo Científico Asesor <strong>de</strong>l<br />
Instituto <strong>de</strong> Investigaciones Biomédicas August Pi i Sunyer (IDIBAPS)<br />
y <strong>de</strong>l Centro Superior en Alta Tecnología Científica para la<br />
Investigación en Biomedicina y Trasplantes <strong>de</strong> Tejidos y Organos <strong>de</strong><br />
la Comunidad Valenciana (CSAT).<br />
Member of the Network of Excellence on Migration and Inflammation<br />
(MAIN) fun<strong>de</strong>d by the European Union / Miembro <strong>de</strong>l Network of<br />
Excellence on Migration and Inflammation (MAIN) fun<strong>de</strong>d by the<br />
European Union.<br />
Salcedo, A., Mayor F Jr ., Penela, P. (2006). Mdm2 is involved in the ubiquitination and <strong>de</strong>gradation of G<br />
protein-coupled receptor kinase 2. EMBO J, 25, 4752-62.<br />
CBM 2005/2006<br />
102<br />
Figura 2. La fosforilación <strong>de</strong> p38MAPK por GRK2 en el “docking groove” ha<br />
permitido <strong>de</strong>scubrir un nuevo mecanismo <strong>de</strong> inhibición <strong>de</strong> la asociación <strong>de</strong> p38<br />
con distintas proteínas celulares.<br />
Figura 2. Phosphorylation of p38MAPK by GRK2 at the docking groove ncovers a<br />
novel mechanism of inhibition of the association of p38 with different partners.<br />
Tutor, A., Penela, P., Mayor, F. (2006). Patología molecular <strong>de</strong> los sistemas <strong>de</strong> señalización betaadrenérgicos.<br />
En “Enfermeda<strong>de</strong>s metabólicas”. Instituto <strong>de</strong> España. Real Aca<strong>de</strong>mia Nacional <strong>de</strong><br />
Farmacia. Editores Fe<strong>de</strong>rico Mayor Zaragoza y María Cascales Angosto, pags. 315-337.<br />
Tutor, A.S., Delpón, E., Caballero, R., Gómez, R., Núñez, L., Vaquero, M., Tamargo, J. Mayor F Jr., Penela,<br />
103