Eidg. Anstalt für Wasserversorgung Abwasserreinigung ...
Eidg. Anstalt für Wasserversorgung Abwasserreinigung ...
Eidg. Anstalt für Wasserversorgung Abwasserreinigung ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
4.2 TRINKWASSERAUFBEREITUNG<br />
Interferenz zwischen Ozon und Chlor bei deren gemeinsamen Anwendung in der<br />
Trinkwasseraufbereitung<br />
29<br />
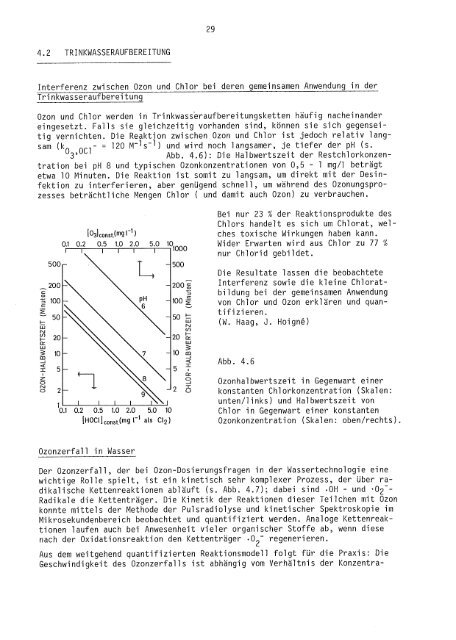
Ozon und Chlor werden in Trinkwass'eraufbereitungsketten häufig nacheinander<br />
eingesetzt. Falls sie gleichzeitig vorhanden sind, können sie sich gegenseitig<br />
vernichten. Die Reaktion zwischen Ozon und Chlor ist jedoch relativ langsam<br />
(k<br />
0 ,0C1 - 120 M-l s -1 ) und wird noch langsamer, je tiefer der pH (s.<br />
3 Abb. 4.6): Die Halbwertszeit der Restchlorkonzentration<br />
bei pH 8 und typischen Ozonkonzentrationen von 0,5 - 1 mg/1 beträgt<br />
etwa 10 Minuten. Die Reaktion ist somit zu langsam, um direkt mit der Desinfektion<br />
zu interferieren, aber genügend schnell, um während des Ozonungsprozesses<br />
beträchtliche Mengen Chlor ( und damit auch Ozon) zu verbrauchen.<br />
1.w<br />
N<br />
i-<br />
Lt<br />
W<br />
Lj<br />
ma<br />
z<br />
1 031 const( m 9 l 1)<br />
0.1 0.2 0.5 1.0 2.0 5.0 10 1000<br />
I I I I 1 I<br />
Bei nur 23 % der Reaktionsprodukte des<br />
Chlors handelt es sich um Chlorat, welches<br />
toxische Wirkungen haben kann.<br />
Wider Erwarten wird aus Chlor zu 77<br />
nur Chlorid gebildet.<br />
500 - r - 500<br />
200 - - 200 i<br />
Die Resultate lassen die beobachtete<br />
Interferenz sowie die kleine Chloratbildung<br />
bei der gemeinsamen Anwendung<br />
100 — P6 -100 von Chlor und Ozon erklären und quan-<br />
50 - - 50<br />
wN(/)<br />
tifizieren.<br />
(W. Haag, J. Hoigné)<br />
20 - -20 11<br />
W<br />
10 -<br />
- ,<br />
7 - 10<br />
-5<br />
co âI Abb. 4.6<br />
8 ° Ozonhalbwertszeit in Gegenwart einer<br />
o 2 —<br />
101<br />
I<br />
0.2<br />
1<br />
I<br />
0.5<br />
I<br />
1.0<br />
I<br />
2.0<br />
9<br />
I<br />
5.0<br />
-2<br />
I<br />
10<br />
3 konstanten Chlorkonzentration (Skalen:<br />
unten/links) und Halbwertszeit von<br />
Chlor in Gegenwart einer konstanten<br />
[HOCI [ const( m 9 (-1 als C12) Ozonkonzentration (Skalen: oben/rechts).<br />
Ozonzerfall in Wasser<br />
Der Ozonzerfall, der bei Ozon-Dosierungsfragen in der Wassertechnologie eine.<br />
wichtige Rolle spielt, ist ein kinetisch sehr komplexer Prozess, der über radikalische<br />
Kettenreaktionen abläuft (s. Abb. 4.7); dabei sind .0H - und •0 2 -<br />
-Radikale die Kettenträger. Die Kinetik der Reaktionen dieser Teilchen mit Ozon<br />
konnte mittels der Methode der Pulsradiolyse und kinetischer Spektroskopie im<br />
Mikrosekundenbereich beobachtet und quantifiziert werden. Analoge Kettenreaktionen<br />
laufen auch bei Anwesenheit vieler organischer Stoffe ab, wenn diese<br />
nach der Oxidationsreaktion den Kettenträger •0 2 — regenerieren.<br />
Aus dem weitgehend quantifizierten Reaktionsmodell folgt <strong>für</strong> die Praxis: Die<br />
Geschwindigkeit des Ozonzerfalls ist abhängig vom Verhältnis der Konzentra-