PDF Download - Laborwelt
PDF Download - Laborwelt
PDF Download - Laborwelt
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Proteomics<br />
�<br />
W I S S E N S C H A F T<br />
Präparative Aufreinigung von<br />
Organellen mit Immuno-FFE<br />
Markus Islinger 1 , Heribert Mohr 1 , Alfred Völkl 1 , Anatomie und Zellbiologie,<br />
Universität Heidelberg; Gerhard Weber, Christoph Eckerskorn; BD Diagnostics, Martinsried<br />
Als trägerfreie Separationstechnik unter kontinuierlichem Durchfluß bietet die Free-Flow-<br />
Elektrophorese (FFE) ein breites Applikationsspektrum bei der Trennung von biologischem<br />
Probenmaterial wie Peptiden, Proteinen, Proteinkomplexen bis zu vollständigen, intakten<br />
Zellorganellen. Hierbei spielt vor allem die hohe Modularität des Systems hinsichtlich der<br />
verwendeten Trennprinzipien eine ausschlaggebende Rolle: So bieten sich Zonenelektrophorese,<br />
isoelektrische Fokussierung oder Isotachophorese als separierendes Prinzip an. Darüber<br />
hinaus besteht jedoch die Möglichkeit, die hohe Affinität von Antigen-Antikörper-Reaktionen<br />
für die Isolierung von Einzelsubstanzen aus komplexen biologischen Gemischen zu nutzen.<br />
Diesbezüglich stellt die Technik der Immuno-Free-Flow-Elektrophorese eine effektive Methode<br />
dar, intakte Organellen aus Zellhomogenaten zu isolieren, die – wenn überhaupt – sonst nur<br />
durch aufwendige Zentrifugationsverfahren anzureichern sind.<br />
Die überraschend niedrige Anzahl von Genen<br />
in den Genomen höherer Organismen legt ein<br />
komplexes Regulationswerk auf der Ebene<br />
der Proteinexpression innerhalb einer Zelle<br />
nahe, das eine Gesamtanzahl von mehreren<br />
hunderttausend Proteinspezies erwarten<br />
läßt. In dieser Hinsicht steht die Proteomforschung<br />
vor der Aufgabe, nicht nur die<br />
Gesamtheit der in einem Organismus auftretenden<br />
Genprodukte zu erfassen, sondern<br />
auch zwischen funktionell unterschiedlichen<br />
Spleißvarianten und posttranlationalen Modifikationen,<br />
wie Phosphorylierungen und<br />
Glycosylierungen zu unterscheiden. Die zunehmende<br />
Automatisierung der massenspektrometrischen<br />
Proteinanalytik erlaubt es zwar<br />
mittlerweile, Proteine in hohem Durchsatz zu<br />
identifizieren und zu quantifizieren, jedoch<br />
erfordert der hohe dynamische Bereich in der<br />
Abundanz unterschiedlicher Proteine meist<br />
eine vorangehende Probenfraktionierung,<br />
um auch gering vertretene, aber potentiell<br />
physiologisch bedeutende Proteine zu erfassen.<br />
Diesbezüglich bietet die Isolierung<br />
von Organellen die Möglichkeit, Zellen nicht<br />
nur effektiv zu fraktionieren, sondern auch<br />
identifizierte Proteine einer für das Organell<br />
spezifischen Aufgabe zuzuordnen und so<br />
erste Hinweise auf die Funktion bisher noch<br />
unbekannter Proteine zu gewinnen.<br />
Meist werden Organellen auf klassische<br />
Weise über mehrere differentielle Zentrifugationsschritte<br />
und/oder Dichtegradientenzentrifugation<br />
gewonnen. Jedoch führen<br />
diese Verfahren häufig zu Materialverlusten<br />
und -veränderungen aufgrund der hohen<br />
mechanischen Belastungen während des<br />
Trennprozesses. Darüber hinaus erlauben sie<br />
keine befriedigende Isolierung von Organellpopulationen<br />
mit ähnlicher Dichte. Als kon-<br />
Abb. 1: BD Free Flow<br />
Electrophoresis-<br />
System<br />
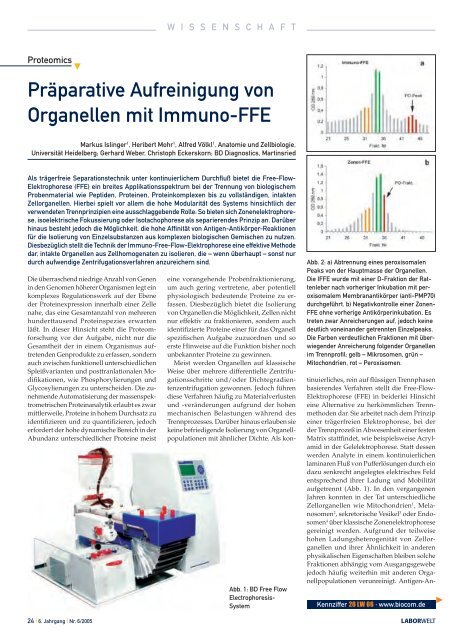
Abb. 2: a) Abtrennung eines peroxisomalen<br />
Peaks von der Hauptmasse der Organellen.<br />
Die IFFE wurde mit einer D-Fraktion der Rattenleber<br />
nach vorheriger Inkubation mit peroxisomalem<br />
Membranantikörper (anti-PMP70)<br />
durchgeführt. b) Negativkontrolle einer Zonen-<br />
FFE ohne vorherige Antikörperinkubation, Es<br />
treten zwar Anreicherungen auf, jedoch keine<br />
deutlich voneinander getrennten Einzelpeaks.<br />
Die Farben verdeutlichen Fraktionen mit überwiegender<br />
Anreicherung folgender Organellen<br />
im Trennprofil: gelb – Mikrosomen, grün –<br />
Mitochondrien, rot – Peroxisomen.<br />
tinuierliches, rein auf flüssigen Trennphasen<br />
basierendes Verfahren stellt die Free-Flow-<br />
Elektrophorese (FFE) in beiderlei Hinsicht<br />
eine Alternative zu herkömmlichen Trennmethoden<br />
dar. Sie arbeitet nach dem Prinzip<br />
einer trägerfreien Elektrophorese, bei der<br />
der Trennprozeß in Abwesenheit einer festen<br />
Matrix stattfindet, wie beispielsweise Acrylamid<br />
in der Gelelektrophorese. Statt dessen<br />
werden Analyte in einem kontinuierlichen<br />
laminaren Fluß von Pufferlösungen durch ein<br />
dazu senkrecht angelegtes elektrisches Feld<br />
entsprechend ihrer Ladung und Mobilität<br />
aufgetrennt (Abb. 1). In den vergangenen<br />
Jahren konnten in der Tat unterschiedliche<br />
Zellorganellen wie Mitochondrien 1 , Melanosomen<br />
2 , sekretorische Vesikel 3 oder Endosomen<br />
4 über klassische Zonenelektrophorese<br />
gereinigt werden. Aufgrund der teilweise<br />
hohen Ladungsheterogenität von Zellorganellen<br />
und ihrer Ähnlichkeit in anderen<br />
physikalischen Eigenschaften bleiben solche<br />
Fraktionen abhängig vom Ausgangsgewebe<br />
jedoch häufig weiterhin mit anderen Organellpopulationen<br />
verunreinigt. Antigen-An-<br />
Kennziffer 20 LW 06 · www.biocom.de �<br />
24 | 6. Jahrgang | Nr. 6/2005 LABORWELT