View/Open - JUWEL - Forschungszentrum Jülich
View/Open - JUWEL - Forschungszentrum Jülich
View/Open - JUWEL - Forschungszentrum Jülich
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
9. Biotransformationen im Zweiphasensystem<br />
Aktivität / U mL −1<br />
0,025<br />
0,020<br />
0,015<br />
0,010<br />
wässrige Phase im<br />
Zweiphasensystem<br />
BA -> BZ<br />
BA -> HPP<br />
0,005<br />
Startkonzentration<br />
homogenes System<br />
0,000<br />
0 5 10 15 20<br />
Benzaldehyd / mM<br />
Aktivität / U mL −1<br />
0,025<br />
0,020<br />
0,015<br />
0,010<br />
0,005<br />
BZ -> HPP<br />
0,000<br />
0 5 10 15 20<br />
(R)-Benzoin / mM<br />
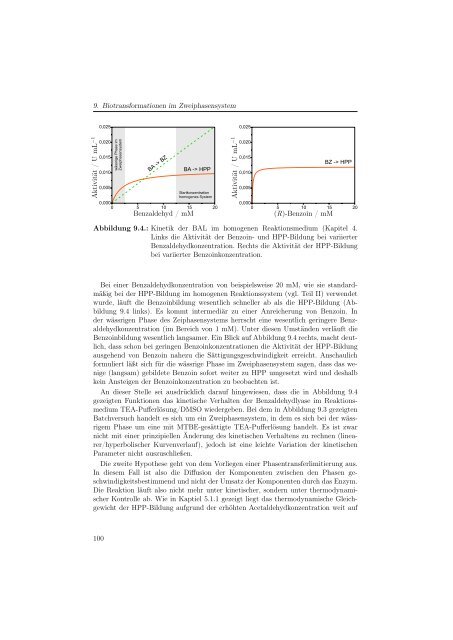
Abbildung 9.4.: Kinetik der BAL im homogenen Reaktionsmedium (Kapitel 4.<br />
Links die Aktivität der Benzoin- und HPP-Bildung bei variierter<br />
Benzaldehydkonzentration. Rechts die Aktivität der HPP-Bildung<br />
bei variierter Benzoinkonzentration.<br />
Bei einer Benzaldehydkonzentration von beispielsweise 20 mM, wie sie standardmäßig<br />
bei der HPP-Bildung im homogenen Reaktionssystem (vgl. Teil II) verwendet<br />
wurde, läuft die Benzoinbildung wesentlich schneller ab als die HPP-Bildung (Abbildung<br />
9.4 links). Es kommt intermediär zu einer Anreicherung von Benzoin. In<br />
der wässrigen Phase des Zeiphasensystems herrscht eine wesentlich geringere Benzaldehydkonzentration<br />
(im Bereich von 1 mM). Unter diesen Umständen verläuft die<br />
Benzoinbildung wesentlich langsamer. Ein Blick auf Abbildung 9.4 rechts, macht deutlich,<br />
dass schon bei geringen Benzoinkonzentrationen die Aktivität der HPP-Bildung<br />
ausgehend von Benzoin nahezu die Sättigungsgeschwindigkeit erreicht. Anschaulich<br />
formuliert läßt sich für die wässrige Phase im Zweiphasensystem sagen, dass das wenige<br />
(langsam) gebildete Benzoin sofort weiter zu HPP umgesetzt wird und deshalb<br />
kein Ansteigen der Benzoinkonzentration zu beobachten ist.<br />
An dieser Stelle sei ausdrücklich darauf hingewiesen, dass die in Abbildung 9.4<br />
gezeigten Funktionen das kinetische Verhalten der Benzaldehydlyase im Reaktionsmedium<br />
TEA-Pufferlösung/DMSO wiedergeben. Bei dem in Abbildung 9.3 gezeigten<br />
Batchversuch handelt es sich um ein Zweiphasensystem, in dem es sich bei der wässrigem<br />
Phase um eine mit MTBE-gesättigte TEA-Pufferlösung handelt. Es ist zwar<br />
nicht mit einer prinzipiellen Änderung des kinetischen Verhaltens zu rechnen (linearer/hyperbolischer<br />
Kurvenverlauf), jedoch ist eine leichte Variation der kinetischen<br />
Parameter nicht auszuschließen.<br />
Die zweite Hypothese geht von dem Vorliegen einer Phasentransferlimitierung aus.<br />
In diesem Fall ist also die Diffusion der Komponenten zwischen den Phasen geschwindigkeitsbestimmend<br />
und nicht der Umsatz der Komponenten durch das Enzym.<br />
Die Reaktion läuft also nicht mehr unter kinetischer, sondern unter thermodynamischer<br />
Kontrolle ab. Wie in Kaptiel 5.1.1 gezeigt liegt das thermodynamische Gleichgewicht<br />
der HPP-Bildung aufgrund der erhöhten Acetaldehydkonzentration weit auf<br />
100