View/Open - JUWEL - Forschungszentrum Jülich
View/Open - JUWEL - Forschungszentrum Jülich
View/Open - JUWEL - Forschungszentrum Jülich
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
5. Biotransformationen im homogenen System<br />
Zu Beginn der Reaktion liegt eine hohe Benzaldehydkonzentration vor. Entsprechend<br />
den im Kapitel 4 erhaltenen Ergebnissen wird zunächst (R)-Benzoin und (R)-<br />
HPP gebildet. Das gebildete Benzoin stellt wiederum ein Substrat für das Enzym dar<br />
und kann mit Acetaldehyd ebenfalls zu HPP reagieren. Wie in Kapitel 4.2.4 gezeigt<br />
entsteht bei dieser Reaktion pro gebildetem Molekül HPP auch ein Molekül Benzaldehyd.<br />
Die Abnahme der Benzaldehydkonzentration verlangsamt sich dadurch, was<br />
auch in Abbildung 5.1 ab ca. 0, 25 h zu erkennen ist. Zum Ende der Reaktion sind<br />
sowohl Benzaldehyd als auch Benzoin nahezu quantitativ in HPP überführt. Der ee<br />
liegt im Batchversuch bei über 99 %.<br />
Werden Batchreaktionen mit einer hohen Startkonzentration von Benzaldehyd durchgeführt<br />
(> 20 mM), so kann die Konzentration des intermediär gebildeten Benzoins<br />
die Grenzlöslichkeit (1,5 mM) im Reaktionssystem überschreiten. Es kommt im Laufe<br />
der Batchreaktion zu einer Präzipitation von Benzoin. Da jedoch das in Lösung verbliebene<br />
Benzoin weiter mit Acetaldehyd zu HPP reagiert, geht der Niederschlag nach<br />
und nach wieder in Lösung.<br />
Das vollständige Abreagieren von Benzaldehyd und Benzoin erleichtert die Produktaufarbeitung<br />
erheblich. Um einen vollständigen Umsatz mit quantitativer Ausbeute<br />
an HPP zu erreichen, kann Acetaldehyd im Überschuss eingesetzt werden. Die erhöhte<br />
Konzentration des Akzeptoraldehyds wirkt als thermodynamische Triebkraft<br />
auf das Reaktionssystem. Der Überschuss an Acetaldehyd kann nach der Reaktion<br />
durch Anlegen eines Vakuums leicht vom Produkt entfernt werden. Um den Einfluss<br />
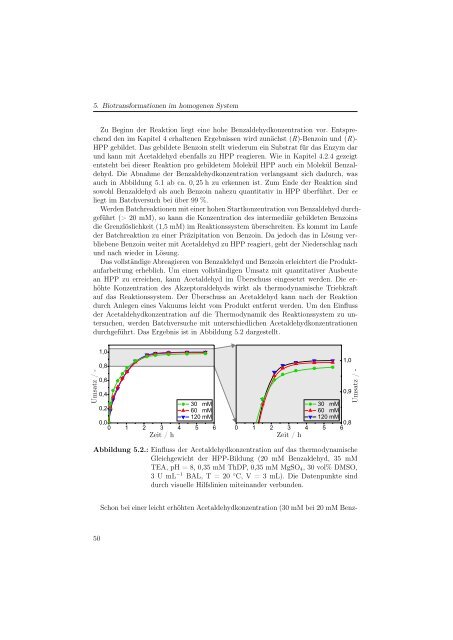
der Acetaldehydkonzentration auf die Thermodynamik des Reaktionssystem zu untersuchen,<br />
werden Batchversuche mit unterschiedlichen Acetaldehydkonzentrationen<br />
durchgeführt. Das Ergebnis ist in Abbildung 5.2 dargestellt.<br />
Umsatz / -<br />
1,0<br />
0,8<br />
0,6<br />
0,4<br />
0,2<br />
30 mM<br />
60 mM<br />
120 mM<br />
0,0<br />
0 1 2 3<br />
Zeit / h<br />
4 5 6<br />
1,0<br />
0,9<br />
0 1 2 3 4 5 6 0,8<br />
30 mM<br />
60 mM<br />
120 mM<br />
Zeit / h<br />
Abbildung 5.2.: Einfluss der Acetaldehydkonzentration auf das thermodynamische<br />
Gleichgewicht der HPP-Bildung (20 mM Benzaldehyd, 35 mM<br />
TEA, pH = 8, 0,35 mM ThDP, 0,35 mM MgSO4, 30vol%DMSO,<br />
3UmL −1 BAL, T = 20 ◦ C, V = 3 mL). Die Datenpunkte sind<br />
durch visuelle Hilfslinien miteinander verbunden.<br />
50<br />
Schon bei einer leicht erhöhten Acetaldehydkonzentration (30 mM bei 20 mM Benz-<br />
Umsatz / -