Grundlagen der elementanalytischen Sternspektroskopie - FG ...
Grundlagen der elementanalytischen Sternspektroskopie - FG ...
Grundlagen der elementanalytischen Sternspektroskopie - FG ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
- 50 -<br />
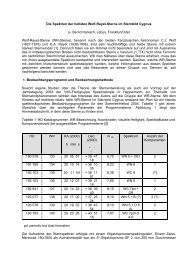
Abbildung 4.1.3.1:Bahndrehimpuls von<br />
p-Elektronen<br />
Die Nomenklatur s,p,d,f... für l = 0,1,2,3... hat sich aus <strong>der</strong> Spektroskopie eingebürgert,<br />
wonach man Spektrallinien den Nebenschalen zuordnete und nach dem Aussehen (sharp,<br />
principle, diffuse, fundamental) glie<strong>der</strong>te.<br />
Am Anfang des Kapitels hielten wir fest, dass die Energieniveaus im Wasserstoffatom nur<br />
von <strong>der</strong> Hauptquantenzahl abhängig sind. Dies beruht zunächst einmal auf <strong>der</strong> Lösung <strong>der</strong><br />
Schrödingergleichung. Anschaulich kann man es jedoch wie folgt darstellen: Das Elektron im<br />
Wasserstoffatom ist vollkommen allein in <strong>der</strong> Atomhülle. Es kann prinzipiell in jedes Orbital<br />
aufsteigen ohne von störenden Einflüssen befallen zu sein. Für das Wasserstoffatom gilt:<br />
E(1s) < E(2s) = E (2p) < E(3s) = E(3p) = E(3d) < E(4s)... Zu jedem l gibt es 2l+1 entartete,<br />
d.h. energetisch gleiche Zustände. Bei komplexeren Elementen befinden sich mehrere<br />
Elektronen in <strong>der</strong> Atomhülle. Diese stören sich aufgrund ihrer Abstoßung und aufgrund <strong>der</strong><br />
Abschirmung 1 . Quantenmechanisch lassen sich die Auswirkungen bei Mehrelektronen-<br />
systemen mit <strong>der</strong> Überlappung von Orbitalen erklären. Durch unterschiedliche radiale<br />
Wahrscheinlichkeitsdichten (Abbildung 4.1.2.9) ergeben sich für Elektronen aus höheren<br />
Hauptschalen, aber geringen Werten von l, erhöhte Wahrscheinlichkeitsdichten<br />
(Nebenmaxima) innerhalb <strong>der</strong> tiefer liegenden Orbitale kleinerer Hauptquantenzahlen. In den<br />
Überlappungsbereichen wirkt die Abschirmung vermin<strong>der</strong>t auf das Orbital, das mit dem<br />
zweiten Maximum in das eigentlich energieärmere Orbital hineinragt. Daraus resultiert eine<br />
stärkere Wirkung <strong>der</strong> Coulombkraft auf das Elektron des Orbitals mit dem größerem Wert<br />
1 Elektronen schirmen die positive Ladung des Atomkerns teilweise gegenüber an<strong>der</strong>en Elektronen ab.