124 V. Experimenteller Teil(5R,6S,9R)-3-Ethyl-6-isopropyl-1,9-dimethyl-1,4-diazaspiro[4.5]dec-3-en-2-on (20)Bei 0 C werden 0.31 ml (0.50 mmol) Butyllithium (15 %ige Lösung in Hexan) zu 2 mlMethanol abs gegeben, gefolgt von der Zugabe von 154 mg (0.46 mmol) Phosphonat 17 in3 ml Methanol abs . Das Gemisch wird 30 min gerührt <strong>und</strong> anschließend mit 0.09 ml(0.52 mmol) Acetaldehyd versetzt <strong>und</strong> weitere 2 h bei 0 °C gerührt. Danach wurde aufRaumtemperatur erwärmt <strong>und</strong> zwei Tage gerührt. Die Mischung wurde mit ges. NH 4 Cl-Lösung gequencht, dreimal mit Diethylether extrahiert <strong>und</strong> mit MgSO 4 getrocknet. NachEntfernen des Lösungsmittels im Vakuum wird ein gelbes Öl erhalten. Die Ausbeute beträgt92 mg (79 %).DC: R f = 0.42 (Dichlormethan/Methanol = 95:5), UV, IodWeitere Analytik siehe Brinkmann [30]16 1713 4 3N7 12 14625 N 18 910 1511O1 H-NMR (400 MHz, CDCl 3 ): δ [ppm] = 2.86 (s, 3 H, NCH 3 ), 2.63 - 2.53 (m, 2 H, CH 2 -16),2.11 - 0.90 (m, 9 H, Menthyl CH, CH 2 ), 1.25 (t, 3 H, 3 J = 7.5 Hz, CH 3 -17), 0.92 (d, 3 H,3 J = 6.6 Hz, CH 3 -11), 0.83 (d, 3 H, 3 J = 6.9 Hz, CH 3 -13/14), 0.59 (d, 3 H, 3 J = 6.8 Hz,CH 3 -13/14).13 C-NMR (100 MHz, CDCl 3 ): δ [ppm] = 169.5 (C-3), 163.4 (C-2), 89.4 (C-5), 47.1 (C-6),45.1 (C-10), 34.8 (C-8), 29.5 (C-9), 25.4 (C-15), 24.0 (C-12), 23.2 (C-13/14), 22.4 (C-7),22.0 (C-16), 21.9 (C-11), 18.1 (C-13/14), 9.8 (C-17).
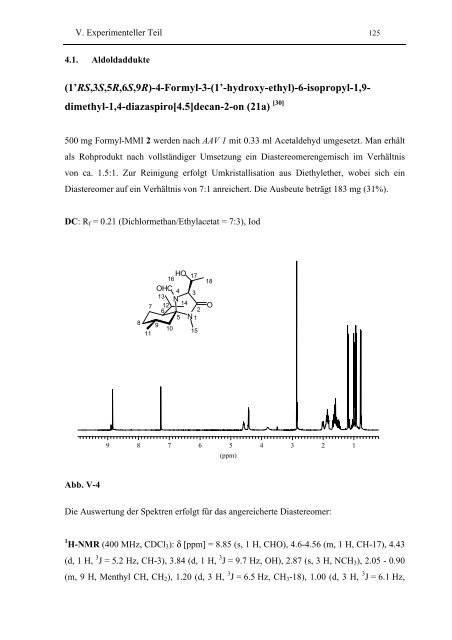
V. Experimenteller Teil 1254.1. Aldoldaddukte(1’RS,3S,5R,6S,9R)-4-Formyl-3-(1’-hydroxy-ethyl)-6-isopropyl-1,9-dimethyl-1,4-diazaspiro[4.5]decan-2-on (21a) [30]500 mg Formyl-MMI 2 werden nach AAV 1 mit 0.33 ml Acetaldehyd umgesetzt. Man erhältals Rohprodukt nach vollständiger Umsetzung ein Diastereomerengemisch im Verhältnisvon ca. 1.5:1. Zur Reinigung erfolgt Umkristallisation aus Diethylether, wobei sich einDiastereomer auf ein Verhältnis von 7:1 anreichert. Die Ausbeute beträgt 183 mg (31%).DC: R f = 0.21 (Dichlormethan/Ethylacetat = 7:3), Iod8711HO 1716OHC 4 313 N12 14625 N 1910 1518O98765(ppm)4321Abb. V-4Die Auswertung der Spektren erfolgt für das angereicherte Diastereomer:1 H-NMR (400 MHz, CDCl 3 ): δ [ppm] = 8.85 (s, 1 H, CHO), 4.6-4.56 (m, 1 H, CH-17), 4.43(d, 1 H, 3 J = 5.2 Hz, CH-3), 3.84 (d, 1 H, 3 J = 9.7 Hz, OH), 2.87 (s, 3 H, NCH 3 ), 2.05 - 0.90(m, 9 H, Menthyl CH, CH 2 ), 1.20 (d, 3 H, 3 J = 6.5 Hz, CH 3 -18), 1.00 (d, 3 H, 3 J = 6.1 Hz,
- Seite 1:
Synthese und Transformationen chira
- Seite 4:
Die vorliegende Arbeit wurde in der
- Seite 7 und 8:
konz.LDAmmCPBAMeMSνNMRNOENOESYoopP
- Seite 9:
Inhaltsverzeichnis3.4. Epoxidation.
- Seite 12 und 13:
2 I. Einleitungwerden. [3] Es trete
- Seite 14 und 15:
4 I. Einleitungwirtsspezifisches Ph
- Seite 17 und 18:
I. Einleitung 7Zur Darstellung von
- Seite 19 und 20:
I. Einleitung 9Anwendungsbreite von
- Seite 21 und 22:
II. Aufgabenstellung 11II. Aufgaben
- Seite 23 und 24:
II. Aufgabenstellung 13aminosäures
- Seite 25:
III. Diskussion und Ergebnisse 15II
- Seite 28 und 29:
18 III. Diskussion und ErgebnisseEi
- Seite 30 und 31:
20 III. Diskussion und ErgebnisseOO
- Seite 32 und 33:
22 III. Diskussion und ErgebnisseOH
- Seite 34 und 35:
24 III. Diskussion und Ergebnisse2.
- Seite 36 und 37:
26 III. Diskussion und ErgebnisseON
- Seite 38 und 39:
28 III. Diskussion und Ergebnissegr
- Seite 40 und 41:
30 III. Diskussion und Ergebnisse21
- Seite 42 und 43:
32 III. Diskussion und Ergebnissebe
- Seite 44 und 45:
34 III. Diskussion und ErgebnisseKo
- Seite 46 und 47:
36 III. Diskussion und ErgebnisseDa
- Seite 48 und 49:
38 III. Diskussion und ErgebnisseEi
- Seite 50:
40 III. Diskussion und ErgebnisseDi
- Seite 53 und 54:
III. Diskussion und Ergebnisse 43Um
- Seite 55 und 56:
III. Diskussion und Ergebnisse 45mi
- Seite 57 und 58:
III. Diskussion und Ergebnisse 47OH
- Seite 59 und 60:
III. Diskussion und Ergebnisse 49zu
- Seite 61 und 62:
III. Diskussion und Ergebnisse 51Me
- Seite 63 und 64:
III. Diskussion und Ergebnisse 53Ab
- Seite 65 und 66:
III. Diskussion und Ergebnisse 55Th
- Seite 67 und 68:
III. Diskussion und Ergebnisse 57De
- Seite 69 und 70:
III. Diskussion und Ergebnisse 59HO
- Seite 71 und 72:
III. Diskussion und Ergebnisse 61ko
- Seite 73 und 74:
III. Diskussion und Ergebnisse 63Be
- Seite 75 und 76:
III. Diskussion und Ergebnisse 65pr
- Seite 77 und 78:
III. Diskussion und Ergebnisse 67OH
- Seite 79 und 80:
III. Diskussion und Ergebnisse 69Re
- Seite 81 und 82:
III. Diskussion und Ergebnisse 71De
- Seite 83 und 84: III. Diskussion und Ergebnisse 73ra
- Seite 85 und 86: III. Diskussion und Ergebnisse 75RX
- Seite 87 und 88: III. Diskussion und Ergebnisse 77Ko
- Seite 89 und 90: III. Diskussion und Ergebnisse 793.
- Seite 91 und 92: III. Diskussion und Ergebnisse 81OH
- Seite 93 und 94: III. Diskussion und Ergebnisse 83Ak
- Seite 95 und 96: III. Diskussion und Ergebnisse 85Hy
- Seite 97 und 98: III. Diskussion und Ergebnisse 87OS
- Seite 99 und 100: III. Diskussion und Ergebnisse 89Ak
- Seite 101 und 102: III. Diskussion und Ergebnisse 91Er
- Seite 103 und 104: III. Diskussion und Ergebnisse 93ac
- Seite 105 und 106: III. Diskussion und Ergebnisse 95OO
- Seite 107 und 108: III. Diskussion und Ergebnisse 97Ei
- Seite 109 und 110: III. Diskussion und Ergebnisse 9944
- Seite 111 und 112: IV. Zusammenfassung 101IV. Zusammen
- Seite 113 und 114: IV. Zusammenfassung 103dieHydroxylf
- Seite 115 und 116: IV. Zusammenfassung 105OR 1ONNR 2OR
- Seite 117 und 118: V. Experimenteller Teil 107HPLC wur
- Seite 119 und 120: V. Experimenteller Teil 1090.66 %ig
- Seite 121 und 122: V. Experimenteller Teil 111organisc
- Seite 123 und 124: V. Experimenteller Teil 113aufgekoc
- Seite 125 und 126: V. Experimenteller Teil 1153.6 ml (
- Seite 127 und 128: V. Experimenteller Teil 117871116 1
- Seite 129 und 130: V. Experimenteller Teil 11924 h am
- Seite 131 und 132: V. Experimenteller Teil 1214. Verbi
- Seite 133: V. Experimenteller Teil 123(3RS,5R,
- Seite 137 und 138: V. Experimenteller Teil 12787112019
- Seite 139 und 140: V. Experimenteller Teil 12987112019
- Seite 141 und 142: V. Experimenteller Teil 13113 C-NMR
- Seite 143 und 144: V. Experimenteller Teil 133(1’S,3
- Seite 145 und 146: V. Experimenteller Teil 135198OHCO
- Seite 147 und 148: V. Experimenteller Teil 1373 J = 6.
- Seite 149 und 150: V. Experimenteller Teil 139weitere
- Seite 151 und 152: V. Experimenteller Teil 141dimethyl
- Seite 153 und 154: V. Experimenteller Teil 14320218192
- Seite 155 und 156: V. Experimenteller Teil 145871119HO
- Seite 157 und 158: V. Experimenteller Teil 147O198711S
- Seite 159 und 160: V. Experimenteller Teil 1492.99 (s,
- Seite 161 und 162: V. Experimenteller Teil 151IR (Film
- Seite 163 und 164: V. Experimenteller Teil 153Alkohols
- Seite 165 und 166: V. Experimenteller Teil 155434 mg (
- Seite 167 und 168: V. Experimenteller Teil 157aromat.)
- Seite 169 und 170: V. Experimenteller Teil 159(12.7) [
- Seite 171 und 172: V. Experimenteller Teil 16187111920
- Seite 173 und 174: V. Experimenteller Teil 1633 J = 7.
- Seite 175 und 176: V. Experimenteller Teil 1654.5. Met
- Seite 177 und 178: V. Experimenteller Teil 167IR (Film
- Seite 179 und 180: V. Experimenteller Teil 169MS (70 e
- Seite 181 und 182: V. Experimenteller Teil 171(2S,3R)-
- Seite 183 und 184: V. Experimenteller Teil 173(3RS,5R,
- Seite 185 und 186:
V. Experimenteller Teil 1758711O201
- Seite 187 und 188:
V. Experimenteller Teil 1771 H-NMR
- Seite 189 und 190:
V. Experimenteller Teil 179EA: C 18
- Seite 191 und 192:
V. Experimenteller Teil 181Anschlie
- Seite 193 und 194:
V. Experimenteller Teil 183anschlie
- Seite 195 und 196:
V. Experimenteller Teil 1858711OS 1
- Seite 197 und 198:
V. Experimenteller Teil 18719,20,21
- Seite 199 und 200:
V. Experimenteller Teil 18913 C-NMR
- Seite 201 und 202:
V. Experimenteller Teil 191(5R,6S,9
- Seite 203 und 204:
V. Experimenteller Teil 1931871117
- Seite 205 und 206:
V. Experimenteller Teil 1951 H-NMR
- Seite 207 und 208:
V. Experimenteller Teil 1971 H-NMR
- Seite 209 und 210:
V. Experimenteller Teil 199EA: C 21
- Seite 211 und 212:
V. Experimenteller Teil 201DC: R f
- Seite 213 und 214:
VI. Literatur 203VI. Literatur[1] a
- Seite 215 und 216:
VI. Literatur 205b) A. G. Myers, J.
- Seite 217 und 218:
VI. Literatur 207[62] E. J. Iwanowi
- Seite 219 und 220:
VI. Literatur 209[102] a) [70]; b)
- Seite 221 und 222:
VI. Literatur 211[132] L. A. Marcau
- Seite 223:
VI. Literatur 213[163] a) C. H. Cum