Química General Un Nuevo Enfoque en la Enseñanza de la Química
Química General Un Nuevo Enfoque en la Enseñanza de la Química
Química General Un Nuevo Enfoque en la Enseñanza de la Química
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Estructura <strong>de</strong> <strong>la</strong> materia y tab<strong>la</strong> periódica 101<br />
¿Sabías qué... los símbolos que se utilizan para los subniveles <strong>de</strong> <strong>en</strong>ergía, están re<strong>la</strong>cionados<br />
con <strong>la</strong> terminología que se utilizó para c<strong>la</strong>sificar <strong>la</strong>s líneas espectrales, <strong>en</strong> los primeros<br />
estudios espectroscópicos <strong>de</strong> los elem<strong>en</strong>tos químicos? Estos grupos <strong>de</strong> líneas se d<strong>en</strong>ominaron:<br />
scharp (líneas nítidas pero <strong>de</strong> poca int<strong>en</strong>sidad), diffuse (líneas difusas), principal<br />
(líneas int<strong>en</strong>sas), fundam<strong>en</strong>tal (líneas frecu<strong>en</strong>tes <strong>en</strong> muchos espectros). De estos nombres<br />
provi<strong>en</strong><strong>en</strong> <strong>la</strong>s letras que ahora se aplican a los subniveles y orbitales<br />
El número cuántico magnético: m = - l l l l l , 0, + ll<br />
ll<br />
l<br />
El número cuántico m se re<strong>la</strong>ciona con <strong>la</strong> ori<strong>en</strong>tación <strong>de</strong> los orbitales d<strong>en</strong>tro <strong>de</strong> un subnivel. Los<br />
orbitales <strong>de</strong> un mismo subnivel difier<strong>en</strong> por su ori<strong>en</strong>tación <strong>en</strong> el espacio y no por su <strong>en</strong>ergía.<br />
Los valores <strong>de</strong> m <strong>de</strong>p<strong>en</strong>d<strong>en</strong> <strong>de</strong>l valor <strong>de</strong> l l l l l , los cuales pued<strong>en</strong> iniciar <strong>de</strong>s<strong>de</strong> -lllll hasta +lllll, incluy<strong>en</strong>do<br />
al cero.<br />
El número <strong>de</strong> valores <strong>de</strong> m para un subnivel dado, especifica el número <strong>de</strong> ori<strong>en</strong>taciones que<br />
pued<strong>en</strong> t<strong>en</strong>er los orbitales <strong>de</strong> ese subnivel y por tanto el número <strong>de</strong> orbitales <strong>en</strong> ese subnivel.<br />
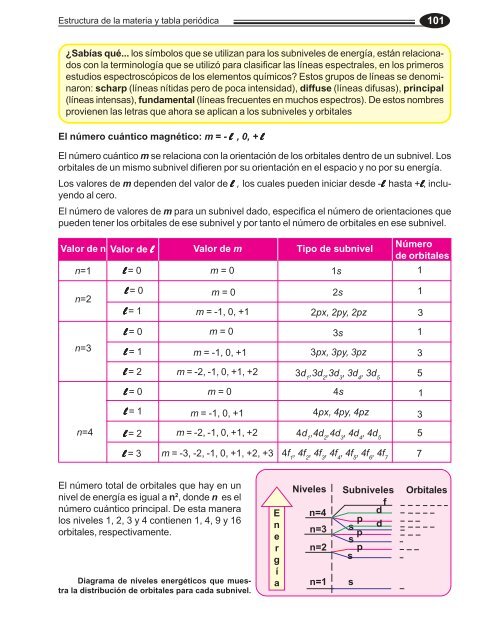
Valor <strong>de</strong> n Valor <strong>de</strong> lllll Valor <strong>de</strong> m<br />
Tipo <strong>de</strong> subnivel<br />
El número total <strong>de</strong> orbitales que hay <strong>en</strong> un<br />
nivel <strong>de</strong> <strong>en</strong>ergía es igual a n 2 , don<strong>de</strong> n es el<br />
número cuántico principal. De esta manera<br />
los niveles 1, 2, 3 y 4 conti<strong>en</strong><strong>en</strong> 1, 4, 9 y 16<br />
orbitales, respectivam<strong>en</strong>te.<br />
Diagrama <strong>de</strong> niveles <strong>en</strong>ergéticos que muestra<br />
<strong>la</strong> distribución <strong>de</strong> orbitales para cada subnivel.<br />
E<br />
n<br />
e<br />
r<br />
g<br />
í<br />
a<br />
Niveles<br />
n=4<br />
n=3<br />
n=2<br />
n=1<br />
s p<br />
d f<br />
d<br />
p<br />
s<br />
s p<br />
Subniveles<br />
s<br />
Número<br />
<strong>de</strong> orbitales<br />
n=1 l l l l l = 0 m = 0<br />
1s 1<br />
n=2<br />
n=3<br />
n=4<br />
l l l l l = 0 m = 0<br />
2s 1<br />
l l l l l = 1 m = -1, 0, +1<br />
2px, 2py, 2pz 3<br />
l l l l l = 0 m = 0<br />
3s 1<br />
l l l l l = 1 m = -1, 0, +1<br />
3px, 3py, 3pz 3<br />
l l l l l = 2 m = -2, -1, 0, +1, +2 3d ,3d ,3d , 3d , 3d 5<br />
1 2 3 4 5<br />
l l l l l = 0 m = 0<br />
4s 1<br />
l l l l l = 1 m = -1, 0, +1<br />
4px, 4py, 4pz 3<br />
l l l l l = 2 m = -2, -1, 0, +1, +2 4d ,4d ,4d , 4d , 4d 5<br />
1 2 3 4 5<br />
ll<br />
l ll<br />
= 3 m = -3, -2, -1, 0, +1, +2, +3<br />
4f , 4f , 4f , 4f , 4f , 4f , 4f 1 2 3 4 5 6 7 7<br />
Orbitales