Química General Un Nuevo Enfoque en la Enseñanza de la Química
Química General Un Nuevo Enfoque en la Enseñanza de la Química
Química General Un Nuevo Enfoque en la Enseñanza de la Química
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
120<br />
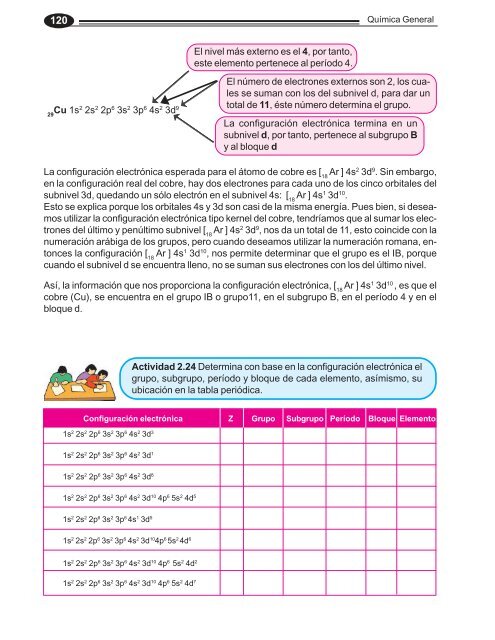
29 Cu 1s2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9<br />
El nivel más externo es el 4, por tanto,<br />
este elem<strong>en</strong>to pert<strong>en</strong>ece al período 4.<br />
<strong>Química</strong> <strong>G<strong>en</strong>eral</strong><br />
El número <strong>de</strong> electrones externos son 2, los cuales<br />
se suman con los <strong>de</strong>l subnivel d, para dar un<br />
total <strong>de</strong> 11, éste número <strong>de</strong>termina el grupo.<br />
La configuración electrónica termina <strong>en</strong> un<br />
subnivel d, por tanto, pert<strong>en</strong>ece al subgrupo B<br />
y al bloque d<br />
La configuración electrónica esperada para el átomo <strong>de</strong> cobre es [ 18 Ar ] 4s 2 3d 9 . Sin embargo,<br />
<strong>en</strong> <strong>la</strong> configuración real <strong>de</strong>l cobre, hay dos electrones para cada uno <strong>de</strong> los cinco orbitales <strong>de</strong>l<br />
subnivel 3d, quedando un sólo electrón <strong>en</strong> el subnivel 4s: [ 18 Ar ] 4s 1 3d 10 .<br />
Esto se explica porque los orbitales 4s y 3d son casi <strong>de</strong> <strong>la</strong> misma <strong>en</strong>ergía. Pues bi<strong>en</strong>, si <strong>de</strong>seamos<br />
utilizar <strong>la</strong> configuración electrónica tipo kernel <strong>de</strong>l cobre, t<strong>en</strong>dríamos que al sumar los electrones<br />
<strong>de</strong>l último y p<strong>en</strong>último subnivel [ 18 Ar ] 4s 2 3d 9 , nos da un total <strong>de</strong> 11, esto coinci<strong>de</strong> con <strong>la</strong><br />
numeración arábiga <strong>de</strong> los grupos, pero cuando <strong>de</strong>seamos utilizar <strong>la</strong> numeración romana, <strong>en</strong>tonces<br />
<strong>la</strong> configuración [ 18 Ar ] 4s 1 3d 10 , nos permite <strong>de</strong>terminar que el grupo es el IB, porque<br />
cuando el subnivel d se <strong>en</strong>cu<strong>en</strong>tra ll<strong>en</strong>o, no se suman sus electrones con los <strong>de</strong>l último nivel.<br />
Así, <strong>la</strong> información que nos proporciona <strong>la</strong> configuración electrónica, [ 18 Ar ] 4s 1 3d 10 , es que el<br />
cobre (Cu), se <strong>en</strong>cu<strong>en</strong>tra <strong>en</strong> el grupo IB o grupo11, <strong>en</strong> el subgrupo B, <strong>en</strong> el período 4 y <strong>en</strong> el<br />
bloque d.<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 5<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 6<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 2<br />
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 7<br />
Actividad 2.24 Determina con base <strong>en</strong> <strong>la</strong> configuración electrónica el<br />
grupo, subgrupo, período y bloque <strong>de</strong> cada elem<strong>en</strong>to, asímismo, su<br />
ubicación <strong>en</strong> <strong>la</strong> tab<strong>la</strong> periódica.<br />
Configuración electrónica Z Grupo Subgrupo Período Bloque Elem<strong>en</strong>to