ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
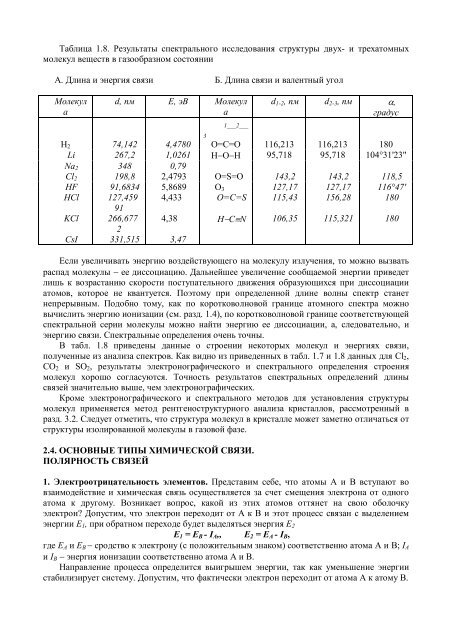
Таблица 1.8. Результаты спектрального исследования структуры двух- и трехатомныхмолекул веществ в газообразном состоянииА. Длина и энергия связи Б. Длина связи и валентный уголМолекулаd, пм Е, эВ Молекула__ 1___2___d 1-2 , пм d 2-3 , пм α,градус3Н 2 74,142 4,4780 O=C=O 116,213 116,213 180Li 267,2 1,0261 Н−O−Н 95,718 95,718 104°31'23"Na 2 348 0,79Cl 2 198,8 2,4793 O=S=O 143,2 143,2 118,5HF 91,6834 5,8689 О 3 127,17 127,17 116°47'НCl 127,459 4,433 O=C=S 115,43 156,28 18091KCl 266,677 4,38 H−C≡N 106,35 115,321 1802CsI 331,515 3,47Если увеличивать энергию воздействующего на молекулу излучения, то можно вызватьраспад молекулы − ее диссоциацию. Дальнейшее увеличение сообщаемой энергии приведетлишь к возрастанию скорости поступательного движения образующихся при диссоциацииатомов, которое не квантуется. Поэтому при определенной длине волны спектр станетнепрерывным. Подобно тому, как по коротковолновой границе атомного спектра можновычислить энергию ионизации (см. разд. 1.4), по коротковолновой границе соответствующейспектральной серии молекулы можно найти энергию ее диссоциации, а, следовательно, иэнергию связи. Спектральные определения очень точны.В табл. 1.8 приведены данные о строении некоторых молекул и энергиях связи,полученные из анализа спектров. Как видно из приведенных в табл. 1.7 и 1.8 данных для Сl 2 ,СО 2 и SO 2 , результаты электронографического и спектрального определения строениямолекул хорошо согласуются. Точность результатов спектральных определений длинысвязей значительно выше, чем электронографических.Кроме электронографического и спектрального методов для установления структурымолекул применяется метод рентгеноструктурного анализа кристаллов, рассмотренный вразд. 3.2. Следует отметить, что структура молекул в кристалле может заметно отличаться отструктуры изолированной молекулы в газовой фазе.2.4. ОСНОВНЫЕ Т<strong>И</strong>ПЫ Х<strong>И</strong>М<strong>И</strong>ЧЕСКОЙ СВЯЗ<strong>И</strong>.ПОЛЯРНОСТЬ СВЯЗЕЙ1. Электроотрицательность элементов. Представим себе, что атомы А и В вступают вовзаимодействие и химическая связь осуществляется за счет смещения электрона от одногоатома к другому. Возникает вопрос, какой из этих атомов оттянет на свою оболочкуэлектрон? Допустим, что электрон переходит от А к В и этот процесс связан с выделениемэнергии Е 1 , при обратном переходе будет выделяться энергия Е 2E 1 = E B - I A ,, E 2 = E A - I B ,где Е A и E B − сродство к электрону (с положительным знаком) соответственно атома А и В; I Aи I B − энергия ионизации соответственно атома А и В.Направление процесса определится выигрышем энергии, так как уменьшение энергиистабилизирует систему. Допустим, что фактически электрон переходит от атома А к атому В.