ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
ГЛАВА 2 СТРОЕНИЕ МОЛЕКУЛ И ХИМИЧЕСКАЯ СВЯЗЬ 2.1 ...
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
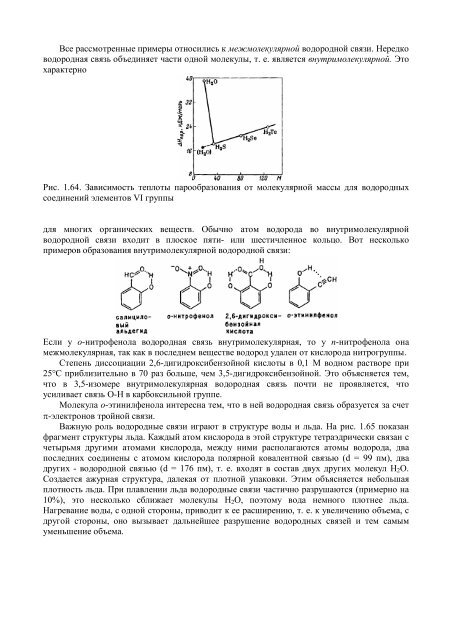
Все рассмотренные примеры относились к межмолекулярной водородной связи. Нередководородная связь объединяет части одной молекулы, т. е. является внутримолекулярной. ЭтохарактерноРис. 1.64. Зависимость теплоты парообразования от молекулярной массы для водородныхсоединений элементов VI группыдля многих органических веществ. Обычно атом водорода во внутримолекулярнойводородной связи входит в плоское пяти- или шестичленное кольцо. Вот несколькопримеров образования внутримолекулярной водородной связи:Если у о-нитрофенола водородная связь внутримолекулярная, то у п-нитрофенола онамежмолекулярная, так как в последнем веществе водород удален от кислорода нитрогруппы.Степень диссоциации 2,6-дигидроксибензойной кислоты в 0,1 M водном растворе при25°С приблизительно в 70 раз больше, чем 3,5-дигидроксибензойной. Это объясняется тем,что в 3,5-изомере внутримолекулярная водородная связь почти не проявляется, чтоусиливает связь O-Н в карбоксильной группе.Молекула о-этинилфенола интересна тем, что в ней водородная связь образуется за счетπ-электронов тройной связи.Важную роль водородные связи играют в структуре воды и льда. На рис. 1.65 показанфрагмент структуры льда. Каждый атом кислорода в этой структуре тетраэдрически связан счетырьмя другими атомами кислорода, между ними располагаются атомы водорода, двапоследних соединены с атомом кислорода полярной ковалентной связью (d = 99 пм), двадругих - водородной связью (d = 176 пм), т. е. входят в состав двух других молекул Н 2 O.Создается ажурная структура, далекая от плотной упаковки. Этим объясняется небольшаяплотность льда. При плавлении льда водородные связи частично разрушаются (примерно на10%), это несколько сближает молекулы Н 2 O, поэтому вода немного плотнее льда.Нагревание воды, с одной стороны, приводит к ее расширению, т. е. к увеличению объема, сдругой стороны, оно вызывает дальнейшее разрушение водородных связей и тем самымуменьшение объема.