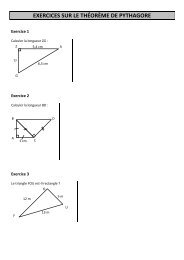
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Qu’en est-il <strong>de</strong> la molécule d’eau ?<br />
Nous avons vu au chapitre précé<strong>de</strong>nt (§3.2) que la molécule d’eau était constituée d’atomes d’oxygène et<br />
d’atomes d’hydrogène. Comment ces atomes sont-ils liés ?<br />
L’atome d’oxygène a tendance à gagner <strong>de</strong>ux électrons pour <strong>de</strong>venir O =<br />
L’atome d’hydrogène a, quant à lui tendance à perdre 1 seul électron pour <strong>de</strong>venir H +<br />
Il est facile <strong>de</strong> comprendre qu’il faudra <strong>de</strong>ux atomes d’hydrogène (chacun donneur d’un électron) pour<br />
satisfaire un atome d’oxygène, d’où la formule bien connue H2O.<br />
Voici <strong>de</strong>ux façon d’expliquer schématiquement ce qui précè<strong>de</strong> :<br />
H +<br />
ou encore<br />
H O<br />
H + (autre métho<strong>de</strong>) 1 2<br />
O =<br />
H2O H2O<br />
H2O<br />
Les atomes qui ont tendance à perdre <strong>de</strong>s électrons (donc ceux <strong>de</strong> gauche dans<br />
le tableau périodique ou encore les métaux) se lient facilement à ceux qui ont<br />
tendance à capter <strong>de</strong>s électrons (donc ceux <strong>de</strong> droite dans le tableau<br />
périodique ou encore les non-métaux)<br />
Autre exemple : comment se lient <strong>de</strong>s atomes <strong>de</strong> chlore et d’aluminium pour former une molécule ?<br />
Cl -<br />
Al +++ Cl -<br />
Cl -<br />
Al Cl<br />
3 1<br />
AlCl3 AlCl3<br />
H<br />
30<br />
Cl<br />
H<br />
Cl<br />
Al<br />
O<br />
Cl<br />
G-M <strong>Jacques</strong><br />
H









![[Document d'intentions pédagogiques] - Collège du Sartay](https://img.yumpu.com/49774314/1/184x260/document-dintentions-pacdagogiques-collage-du-sartay.jpg?quality=85)